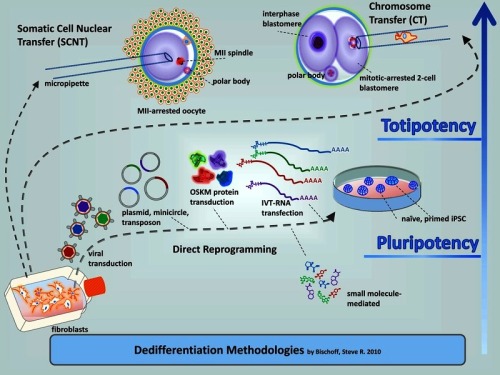
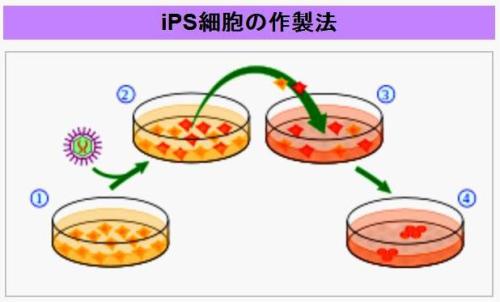
(8)iPS細胞とSTAP細胞【その1】
■ 小保方さん、沈黙破り手記発表 by デイリー
STAP細胞論文問題で研究不正行為が確定した、論文の著者で理化学研究所の元研究員・小保方晴子氏(32)が、手記「あの日」
(講談社)を28日に出版することが27日、分かった。‥‥ (2020.05.17.Sun.)
■ 常識覆す成果 STAP細胞 -NHK web特集2014年1月31日 21時25分
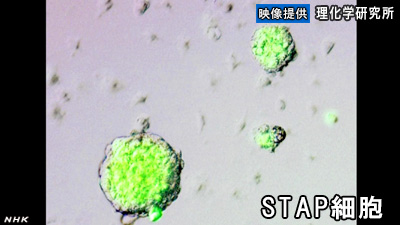
理化学研究所などのグループが作製に成功した新しい万能細胞、「STAP細胞」。
いったん組織や臓器になったあとの哺乳類の細胞が、外部からの刺激だけでそれらの役割が決まる前の元の細胞に戻るという、
従来の常識を覆す成果に世界中から注目が集まっています。
その具体的な仕組みやiPS細胞との違い、将来の医療への応用に向けた課題はどこにあるのか、
さらに残された科学的な謎とは何か。
科学文化部の中川真記者と神戸放送局の鈴木健吾記者が解説します。
STAP細胞とは
STAP細胞は、神戸市にある理化学研究所発生・再生科学総合研究センターの小保方晴子研究ユニットリーダーなどのグループが作製に成功し
ました。
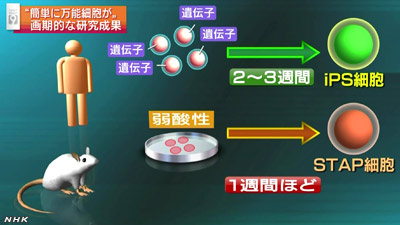
生まれてまもないマウスのリンパ球を弱酸性の液体に30分ほど浸し、その後、培養したところ、
さまざまな種類の細胞に変化する能力を維持する遺伝子が活性化することを突き止めました。
そしてこの細胞をマウスの体内に入れると、実際に皮膚や筋肉などのさまざまな細胞に変化する万能性が確認されたのです。
弱酸性の溶液に浸すほかにも、細胞に外から力を加えたり薬剤で細胞膜に穴を開けるなどほかの形で刺激を加えてもこうした現象が確認され、
「刺激を与えることでさまざまな細胞になる能力を獲得した」
ことを意味する英語の頭文字から「STAP細胞」と名付けました。
何が常識外れなのか
従来、哺乳類の細胞は、特定の組織や臓器になる「分化」を起こすとそれらの役割が決まる前の元の細胞に戻ることはないと考えられてきました。
これに対し、京都大学iPS細胞研究所の山中伸弥教授は、皮膚などの細胞の核に特定の遺伝子を入れることで、
組織や臓器になる前の受精卵のような状態に戻す、「初期化」が起きることを世界で初めて示し、「iPS細胞」を作り出すことに成功しました。
今回作製されたSTAP細胞は遺伝子を入れるなどの操作をしなくても、細胞の外部からの刺激だけで初期化が起きることを初めて示した点が画期
的で、海外のメディアも大きく取り上げています。
iPS細胞と何が違う
このSTAP細胞、作り方のほかにもiPS細胞と異なる点があります。
研究グループによりますと、iPS細胞は作り出すのに2週間から3週間かかりますが、STAP細胞は1週間ほどでできるということです。
iPS細胞はもとになる細胞から変化できる割合が1%未満ですが、STAP細胞は7%から9%程度と高いのも特徴です。
また、iPS細胞やES細胞は胎盤を作る能力がありませんが、STAP細胞からは胎盤も作れることが確認され、
より受精卵に近い状態まで初期化が進んでいると見られています。
一方、iPS細胞やES細胞は細胞分裂を続けて増殖を続ける能力「自己複製能」がありますが、STAP細胞そのものにはその能力がありません。
しかし、特殊な培養液で改めて培養を続けるとこうした能力を持つ細胞に変化することも分かりました。
成功までの道のり
世界中の注目を集めた画期的な成果ですが、ここまでの道のりは平たんではありませんでした。
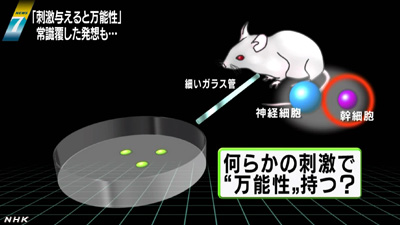
小保方さんが、STAP細胞のアイデアを思いついたのは、アメリカのハーバード大学医学部に留学していた20代半ばのころでした。
マウスの神経や筋肉の細胞を細長い管に入れて通す実験をしていたところ管に入れたものとは異なる小さい細胞が出てきたのです。
詳しく調べるといわゆる万能細胞にあるOct4という遺伝子が活発に働いていました。
神経や筋肉の細胞が、細長い管の中を通る刺激で万能性を獲得するような変化をおこしたのではないかと、小保方さんは発想しました。
しかし、外部からの刺激だけで細胞が万能性を獲得するという考えは、生物学の常識からは外れたもので、
周囲からの理解もなかなか得られなかったといいます。
転機が訪れたのは、3年前、神戸の理化学研究所に移った時です。
クローン技術で世界的に知られた研究者若山照彦さんが上司となり、この発想を理解してくれました。
小保方さんは、若山さんと一緒に動物実験を進めデータをそろえてイギリスの権威ある科学雑誌「ネイチャー」に投稿しましたが
「あなたは過去何百年にわたる細胞生物学の歴史を愚弄している」
と厳しいコメントを受け取ったといいます。
しかし、諦めずに実験を続け、多くのデータをそろえて再びネイチャーに投稿し、今回ようやく、その研究成果が世界に認められました。
医療への応用は
期待が高まるのが、再生医療など人の病気やけがを治す医療への応用です。
そのうえで最大の焦点は、ヒトの細胞からでも同じような細胞が作り出せるどうかです。
iPS細胞などを使った研究を行っている慶応大学医学部の岡野栄之教授は
「マウスとヒトでは細胞の性質も違い、マウスでうまくいってもヒトではうまくいかない実験もある。
ただiPS細胞が作製されて以来、いろいろな実験技術が開発され研究がスピードアップしているので意外に近いかもしれない」
と話していました。
今回の研究の共同研究者で理化学研究所発生・再生科学総合研究センターの副センター長を務める笹井芳樹さんは、
ヒトなどでもSTAP細胞ができるよう研究を進めていることを明らかにし、
「ヒトの再生医療に応用するには、成人の細胞から作る必要がある。iPS細胞のように、100歳を超えた人からも作れるよう、
研究に力を入れたい」
としています。
ヒトでの作製が成功すれば安全性が課題となります。
STAP細胞は外部からの刺激だけで作れることから、がんになるおそれが低いとみられていますが、
医療に応用するには厳しく安全性を確認することが求められることになります。
残された謎は
今回の研究では、科学的な側面で興味深い謎も新たに浮かび上がりました。
外部からの刺激という極めて簡単な方法で万能性が獲得される点が生物学の常識を覆す画期的な成果とされていますが、
その原理はまだ分かっていません。
体の中ではなぜこうした変化が起こらないのか、そのメカニズムも謎です。
また今回の研究は生まれて間もないマウスの細胞を中心に行われましたが、マウスの年齢が上がるとSTAP細胞のできる確率が下がることも
確認されていて、なぜ年齢が影響を及ぼすのかといった点も研究者の関心を集めています。
STAP細胞はiPS細胞を作る方法に比べて簡単な方法でできるため、多くの研究機関が研究に取りかかると見られていて、
こうした点をはじめ細胞の万能性や初期化に関する仕組みの解明が進むことが期待されています。
小保方さんは、
「初期化を制御する原理の解明を将来的に目指していきたい。
この原理を解明することで細胞の状態を自在に操作できる技術ができるのではないか」
と話しています。
世界を驚かせた今回の研究。
将来、治らなかった病気が治せるようになる医療の実現に期待が高まるとともに、生物の細胞にはまだ私たちの知らない不思議なメカニズムが
備わっていることを改めて教えてくれます。
■ 弱酸性溶液に浸すだけで「万能細胞」作成に成功 -NHKweb 2014年1月29日 22時48分
皮膚などの体の細胞を弱酸性の溶液に30分間ほど浸すだけで体のさまざまな組織になる「万能細胞」を作り出すことにマウスの実験で成功したと
理化学研究所などの研究グループが発表しました。
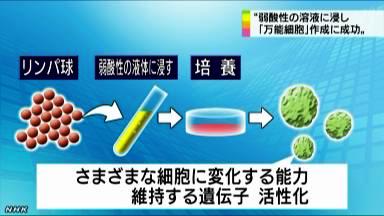
これまでの生物学の常識を覆す画期的な成果として注目を集めています。
神戸市にある理化学研究所発生・再生科学総合研究センターの小保方晴子研究ユニットリーダーなどのグループは、生まれてまもないマウスの
リンパ球を弱酸性の液体に30分ほど浸し、その後、培養したところ、さまざまな種類の細胞に変化する能力を維持する遺伝子が活性化することを
突き止めました。
そしてこの細胞をマウスの体内に入れると、実際に皮膚や筋肉などのさまざまな細胞に変化するのを確認できたということで、「刺激を与えることで
さまざまな細胞になる能力を獲得した」ことを意味する英語の頭文字から「STAP(スタップ)細胞」と名付けました。
こうした能力を持つ細胞は、皮膚などの細胞に遺伝子を入れて作るiPS細胞などが知られていますが、今回は外部からの刺激というより簡単な方
法で短時間に作れるものとして注目されています。
小保方ユニットリーダーは「iPS細胞などと違い、周りの環境を変えて刺激を与えるだけで細胞が変化するという革新的な技術で、再生医療や免疫
の研究などに貢献できるのではないか」と話しています。
研究グループは、今後、ヒトの細胞でも同じことができるか、研究を進めることにしています。
iPS細胞とSTAP細胞
研究チームによりますと、iPS細胞は作り出すのに2週間から3週間かかりますが、STAP細胞は1週間ほどでできるということです。
またiPS細胞のように遺伝子を入れる操作が必要ないうえ、外部からの刺激という簡単な方法で効率よく作り出せるため研究がしやすく、今後、さ
まざまな研究者が参入して研究の進展が期待できるということです。
STAP細胞作成の意義
体のさまざまな組織になる万能細胞を作り出す研究は、iPS細胞をはじめとして世界各国で行われています。
万能細胞を作るには皮膚や肝臓など体の細胞が持つ記憶をいったん消去し、受精卵のような状態に戻してやる必要があります。
こうした過程は「初期化」と呼ばれますが、例えばiPS細胞では、遺伝子を細胞の中に入れることでこの初期化を起こしていました。
初期化は、動物の細胞、特にほ乳類の細胞では周囲の環境を変えるくらいではできないと考えられてきましたが、今回の研究成果はこの常識を覆
したと評価されています。
国立成育医療研究センターの阿久津英憲室長は「細胞の周りの環境を少し変えるだけであらゆる体の組織になる能力を獲得するというのは、今ま
での常識では考えられない画期的な成果だ。作り方もiPS細胞のように遺伝子を導入することなく非常に簡単な方法なので研究が世界中に広がる
のではないか。将来的にはヒトの体の細胞を自由自在にさまざまな組織に変化させる薬を作って病気を治すような、新たな再生医学の展開につな
がるかもしれない」
と話しています。
山中伸弥教授「人間で成果得られること期待」
今回の研究成果について京都大学iPS細胞研究所の山中伸弥教授は「興味深い研究で、細胞の初期化を理解するうえで重要な成果である。医学
応用の観点からiPS様細胞の新しい樹立法とも捉えることができ、人間でも同様の方法でできた場合、従来の方法とさまざまな観点から比較検討
する必要がある。今後、人間で成果を得られることを期待している」
というコメントを出しました。
また、iPS細胞などを使った研究を行っている慶応大学医学部の岡野栄之教授は「体のさまざまな組織に変化する細胞を作り出すのに遺伝子の
導入や薬剤を使わずに成功したのはこれが初めてだ。しかもしっかりした手法で証明している点は高く評価できる。遺伝子の導入やクローン技術に
続く、第3の方法として発展する可能性が期待でき、画期的だ」
と話しています。
■ iPS細胞 初の治療 患者に明るい光 (NHK-WEB特集)2013年6月27日 19時35分
iPS細胞を使って目の網膜の一部を再生し、病気で失われた患者の視力を回復させる臨床研究について、
厚生労働省の審査委員会は、26日、計画の内容は妥当だとして実施を了承しました。
世界初となる臨床研究の実施に見通しがついたことで、今後、iPS細胞を患者の治療に生かすためのさまざま
な研究が加速していくとみられます。
iPS細胞を使った臨床研究の可能性と課題について科学文化部の信藤敦子記者が解説します。‥‥
■ iPS細胞を動物体内で変化させ治療に
2013年5月14日 22時29分 – NHK-NEWSweb
体のさまざまな組織になるヒトのiPS細胞を動物の体内で変化させ、移植可能な血液のもととなる細胞を作り出
すことに東京大学の研究グループがマウスの実験で成功したと発表しました。
骨髄移植に代わる新たな治療法の開発につながる可能性があるとしています。
東京大学医科学研究所の研究グループは、iPS細胞を試験管の中で血液のもととなる細胞に変化させ、移植
しても今の技術では定着しないことから試験管とは異なる、動物の体内の環境に着目しました。
そして、ヒトのiPS細胞をマウスの皮膚に注入して血液のもととなる細胞に変化させ、さらに別のマウスに移植
したところ、そのまま定着して、白血球や赤血球など血液の細胞になることを確認したということです。
また、この方法を応用して、遺伝性の血液の病気があるマウスのiPS細胞に正常に働く遺伝子を入れ、血液の
もととなる細胞に変化させてから元のマウスに移植すると病気の治療に成功したとしています。
こうしたことから、研究グループは動物の体内を利用すれば遺伝子治療を含め、血液の病気で骨髄移植に代
わる新たな治療法の開発につながる可能性があるとしています。
研究を指導した中内啓光教授は
「安全性などの問題があるため、実用化には時間がかかるが、
患者自身のiPS細胞を使った血液の病気の新たな治療法に向け、重要な一歩と言える」
と話しています。
■ iPS細胞 in Wikipedia
■ iPS細胞=人工多能性幹細胞 (じんこう たのうせい かんさいぼう、英: induced pluripotent stem cells)とは、体細胞へ数種類の遺伝子を導入することにより、ES細胞(胚性幹細胞)のように非常に多くの細胞に分化できる分化万能性 (pluripotency)と、分裂増殖を経てもそれを維持できる自己複製能を持たせた細胞のこと。
英語名の頭文字を採って iPS細胞 (アイピーエスさいぼう:iPS cells, iPSCs)と呼ばれるほか、英語名の意訳で誘導多能性幹細胞(ゆうどう たのうせい かんさいぼう)とも呼ばれる。
命名者の山中教授が最初を小文字の「i」にしたのは、当時世界的に大流行していた米アップルの携帯音楽プレーヤーである『iPod』のように普及してほしいとの願いが込められている。
2006年(平成18年)、山中伸弥率いる京都大学の研究グループによってマウスの線維芽細胞(皮膚細胞)から初めて作られた。
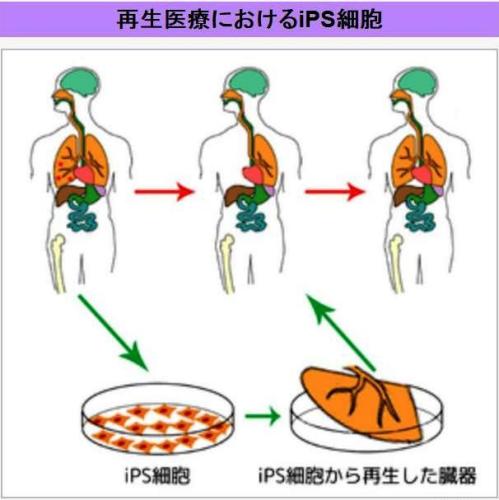
▲ 肺の再生へのiPS細胞の適用例を示す模式図
再生医療におけるiPS細胞の実用化は未だ成されていない。
▲ 退行分化法
図の説明は英語版を参照のこと。
概要
元来、生物を構成する種々の細胞に分化し得る分化万能性は、胚盤胞期の胚の一部である内部細胞塊や、そこから培養されたES細胞(胚性幹細胞)、および、ES細胞と体細胞の融合細胞、一部の生殖細胞由来の培養細胞のみに見られる特殊能力であったが、iPS細胞の開発により、受精卵やES細胞を全く使用せずに分化万能細胞を単離培養することが可能となった。
分化万能性を持った細胞は理論上、体を構成するすべての組織や臓器に分化誘導することが可能であり、ヒトの患者自身からiPS細胞を樹立する技術が確立されれば、拒絶反応の無い移植用組織や臓器の作製が可能になると期待されている。
ヒトES細胞の使用において懸案であった、胚盤胞を滅失することに対する倫理的問題の抜本的解決に繋がることから、再生医療の実現に向けて、世界中の注目が集まっている。
また、再生医療への応用のみならず、患者自身の細胞からiPS細胞を作り出し、そのiPS細胞を特定の細胞へ分化誘導することで、従来は採取が困難であった組織の細胞を得ることができ、今まで治療法のなかった難病に対して、その病因・発症メカニズムを研究したり、患者自身の細胞を用いて、薬剤の効果・毒性を評価することが可能となることから、今までにない全く新しい医学分野を開拓する可能性をも秘めていると言える。
しかし、この技術を使えば男性から卵子、女性から精子を作るのも可能となり、同性配偶による子の誕生も可能にするため、技術適用範囲については大いに議論の余地が残っている。
さらには、iPS細胞は発癌遺伝子を導入するなどして癌細胞と同じように無限増殖性を持たせた人工細胞であり、遺伝子導入の際に使用しているレトロウイルスなどが染色体内のランダムな位置に発癌遺伝子などの遺伝子を導入してしまうため、もともと染色体内にある遺伝子に変異が起こって内在性発癌遺伝子を活性化してしまう可能性があるなど、実際に人体に移植・応用するには大きな課題が残っている。
それ以前
植物は基本的には組織切片から全体を再生することができる。
例えばニンジンを5mm角程度に切り出し、エタノールなどにつけて消毒し、適切な培地に入れて適切な(温度・日照などの)条件におけば胚・不定芽などを経て生育し、元のニンジン同様の形になる(組織培養)。
しかし、(高等)動物では、受精卵以外の組織はこうした能力(全能性)を持たない。
一方、培養下において、全ての組織に分化し得る能力(分化万能性)を持つ細胞は存在する。
一般論をいえば、これらの分化万能性を持つ動物の細胞を適切な培地にいれて適切な条件で培養しても、秩序だった組織は形成されず、細胞の塊ができるだけである。
しかし、これらの細胞から組織、器官を分化・形成させることができれば、事故や病気などで失ってしまった体の部分を移植元の人体の提供なしに移植することができる。
また、他人の組織移植に伴う拒絶反応の発生を抑制することも可能となると考えられる。
そのため、培養による組織の形成には様々な試みがなされてきた。
ES細胞はその代表例であり、体を構成する様々な細胞に分化誘導できることが知られていた。
しかしES細胞は発生初期の胚からしか得ることができず、胚の採取が母体に危険を及ぼすことや、個体まで生育しうる胚を実験用に滅失してしまうことについては倫理的な問題が指摘されている。
そのため、皮膚や血液など、比較的安全に採取でき、再生が可能な組織からの分化万能性をもった細胞の発見が期待されていた。
iPS細胞樹立の背景
ヒトの体はおよそ60兆個の細胞で構成されているが、元をたどればこれらの細胞はすべて、たった一つの受精卵が増殖と分化を繰り返して生まれたものである。
この受精卵だけが持つ完全な分化能を全能性 (totipotency) と呼び、ヒトを構成するすべての細胞、および胎盤などの胚体外組織を自発的に作り得る能力を指す。
受精卵が胚盤胞まで成長すると、胚体外組織を形成する細胞と、個体を形成する細胞へと最初の分化が起こる。
後者の細胞は内部細胞塊に存在し、胚体外組織を除くすべての細胞へ分化できることから、これらの細胞がもつ分化能を分化万能性 (pluripotency) と呼ぶ。
この内部細胞塊から単離培養されたES細胞もまた分化万能性を持ち、個体を構成するすべての細胞に分化できる。
なお、成人にも神経幹細胞や造血幹細胞など、種々の幹細胞が知られているが、これらの幹細胞のもつ分化能は、神経系や造血系など一部の細胞種に限られているため、多能性 (multipotency) と呼ばれている。
ES細胞などの分化万能細胞は、培養条件によって分化万能性を維持したまま増殖したり、多種多様な細胞へ分化することができる。
しかしながら、同一個体においては、分化万能細胞も体細胞も核内にもつ遺伝子の塩基配列は(テロメアなど一部を除き)全く同一であり、分化能の違いは、様々な遺伝子の発現量と、それを制御するクロマチン修飾、及びDNAメチル化などのエピジェネティックな情報の違いに由来すると考えられている。
例えば、ES細胞はOct3/4やNanogなどの遺伝子を発現してES細胞としての分化万能性を維持しているが、終末分化した体細胞ではこれらの遺伝子は発現していない。
全ての体細胞はOct3/4やNanogの遺伝子を核内に持ってはいるが、様々な転写因子やエピジェネティック機構により、発現が抑制されているのである。
こうした遺伝子発現パターンの違いを解析し、人為的に切り替えることができれば、分化した体細胞を未分化な分化万能細胞へと戻すこと(初期化[リプログラミング])ができると考えられていた。
この仮説を裏付けていたのが、核移植技術によるクローン胚作製の成功である。
すなわち、体細胞の核を取り出し、核を取り除いた未受精卵内に移植することによって、核内の遺伝子発現パターンが未分化な細胞のパターンにリプログラムされることが示されている。
また、体細胞をES細胞と融合させることにより、体細胞の遺伝子発現がES細胞様に変化することも知られていた。
これはつまり、卵やES細胞の中に、核内のエピジェネティックな情報をリプログラムすることが可能な因子が含まれていることを意味している。
ただし、その因子が一体何であるのかは、長い間謎に包まれていた。
マウスiPS細胞の樹立
▲1.生体から得た細胞を培養する。
2.ベクターを用いて分化万能性の獲得に必要な遺伝子を導入する(赤色が遺伝子導入された細胞)。
3.細胞をいったん集め、ES細胞の培養法にしたがい、フィーダー細胞の存在下、専用培地で培養する。
4.遺伝子導入された細胞の一部がiPS細胞となり、ES細胞様のコロニーを形成する。
山中らのグループは、体細胞を多能性幹細胞へとリプログラムする因子を探索する過程で、ES細胞に特異的に発現するFbx15という遺伝子に着目し、Fbx15遺伝子座中の構造遺伝子をネオマイシン耐性遺伝子と入れ換えたノックインマウスを作製していた。
このマウスには明らかな異常は認められなかったが、山中らは
『通常はFbx15を発現しない線維芽細胞が、何らかの方法で多能性を獲得するとFbx15を発現するようになる』
との仮説を立て、このノックインマウス由来の線維芽細胞にレトロウイルスベクターを用いて候補遺伝子を導入した後、ES細胞増殖の条件でG418を添加して培養するという実験系を構築した(図)。
彼らの仮説に基づけば、Fbx15を発現しない線維芽細胞はG418によって死滅するが、多能性を獲得した細胞はFbx15遺伝子座上のネオマイシン耐性遺伝子が発現し、G418耐性となって生き残ると考えられた。
ES細胞で特異的に発現し、分化万能性の維持に重要と考えられる因子を中心に、24個の候補遺伝子を選んで導入実験を行ったが、どの遺伝子も単独ではG418耐性を誘導できなかった。
そこで24個すべての遺伝子を導入したところ、G418耐性の細胞からなるコロニーを複数形成することに成功した。
この細胞を分離培養するとES細胞に酷似した形態を示し、長期に継代可能であった。
彼らはこのES様細胞株を「iPS細胞」と命名し、24遺伝子の絞り込みを行い、最終的にiPS細胞を樹立するには4遺伝子で十分であることを突き止めた。
この4遺伝子はOct3/4・Sox2・Klf4・c-Mycで、発見者の名を取り“山中因子 (Yamanaka factors)”とも呼ばれている。
これらの研究成果は、2006年8月にセル誌に掲載された。
マウスiPS細胞作製法の改良
Fbx15遺伝子の発現によって選別され樹立されたiPS細胞は、細胞形態や増殖能、分化能などにおいてES細胞と極めて良く似ていたが、一部の遺伝子の発現パターンや、DNAメチル化パターンなどはES細胞と異なっていた。
また、ヌードマウスの皮下に移植すると3胚葉成分からなる奇形腫をつくることができるが、胚盤胞に注入してもiPS細胞由来の細胞が混在したキメラマウスは産まれなかったことから、ES細胞と同様の分化万能性を持つとは言い難かった。
山中らは、ES細胞の万能性維持に重要なNanog遺伝子の上流にGFPおよびピューロマイシン(英語版)耐性遺伝子を挿入したトランスジェニックマウス (cf. en) を作製し、このマウス由来の線維芽細胞に上述の4遺伝子を導入して、Nanogの発現レベルによってiPS細胞を選別、樹立した。
2007年7月に発表されたこの改良iPS細胞(Nanog-iPS細胞)は、オリジナルのiPS細胞(Fbx15-iPS細胞)に比べてよりES細胞に近い遺伝子発現パターンを示し、胚盤胞への注入により成体キメラマウスを得ることが可能で、さらにキメラマウスとの交配で次世代の子孫にiPS細胞に由来する個体が産まれること (germline transmission) が確認された。
時をほぼ同じくして、マサチューセッツ工科大学 (MIT) のルドルフ・ヤニッシュ(英語版)らのグループ、ハーバード大学ハーバード幹細胞研究所のコンラッド・ホッケドリンガー (Konrad Hochedlinger) とカリフォルニア大学ロサンゼルス校 (UCLA) のキャスリン・プラース (Kathrin Plath) らのグループからも、同様の研究成果が報告された。
遺伝子導入によって多能性を獲得した細胞を選別する際に、Fbx15やNanogなど特定の遺伝子の発現を指標とする場合、GFPや薬剤耐性遺伝子などのレポーター遺伝子を特定の遺伝子座に組み込んだトランスジェニックマウスやノックインマウスなどの遺伝子改変動物が必要となる。
しかし、ヒトの場合はこれらの遺伝子改変技術は適用できないため、iPS細胞の樹立に際して大きな障害となっていた。
2007年8月、ヤニッシュらのグループは、野生型マウス由来の線維芽細胞に4遺伝子を導入後、細胞の形態変化によってiPS細胞を選別、単離することに成功し、遺伝子改変マウスを用いなくてもiPS細胞が樹立できることを報告、ヒトiPS細胞の樹立へと道を拓いた。
同年9月には、カリフォルニア大学サンフランシスコ校のミゲル・ハマーリョ-サントス (Miguel Ramalho-Santos) らのグループも、薬剤による選別を行わず、c-Mycの代わりにn-Mycを、またレトロウイルスベクターの一種であるレンチウイルスベクターを用いてiPS細胞を樹立した。
iPS細胞の癌化についても、様々な改善方法が試みられている(後に詳述)。
ヒトiPS細胞の樹立
マウス(ハツカネズミ属)とヒト(ヒト属)は遺伝子レベルで多くの類似性があるものの、マウスES細胞とヒトES細胞とでは、培養法や発現している遺伝子の種類などにおいていくつか異なる点がある。
マウスiPS細胞の成功を受けて、同様の手法がヒトへも応用可能であるか大きな関心が集まった。
山中ら京大グループは、マウスiPS細胞の樹立に用いた4遺伝子のヒト相同遺伝子であるOCT3/4・SOX2・KLF4・C-MYCを、ヒト由来線維芽細胞(36歳女性の顔面の皮膚由来の線維芽細胞、69歳男性由来の滑膜細胞、および新生児包皮由来の線維芽細胞)に導入してヒトiPS細胞の樹立に成功した。
また、世界で初めてヒトES細胞を樹立したことで知られるジェームズ・トムソン(英語版)らのグループも、山中らがマウスiPS細胞を初めて樹立した時と同じ戦略を用い、14個の候補遺伝子の中からOCT3/4・SOX2・NANOG・LIN28の4遺伝子を選び出してヒトiPS細胞の樹立に別個に成功した。
両グループの研究成果は、2007年11月20日、山中らの報告がセル誌に、トムソンらの報告がサイエンス誌にそれぞれ同日発表された。
そのわずか後の12月には、ハーバード幹細胞研究所のジョージ・デイリー (George Daley) らのグループも、OCT3/4・SOX2・KLF4・C-MYCの4遺伝子にhTERT・SV40 large Tを加えた6遺伝子を用いてヒトiPS細胞の樹立に別個に成功しており、競争の激しさが窺える。
この報告では、山中らやトムソンらが市販されている培養細胞を用いたのとは異なり、成人男性の手掌の皮膚から採取した細胞をもとにiPS細胞を樹立しており、実際にヒトの個体からiPS細胞を樹立可能であることが示された。
特許権をめぐる競争
ヒトiPS細胞の樹立については、山中ら京大グループよりもバイエル薬品が先行していた可能性が指摘された。
山中らの実験を聞いた2006年8月に開発に着手し、2007年春には作製に成功していたという。
これは山中らの論文発表(2007年11月)に先行する。
一方、実際の特許出願時期は、バイエル社の2007年6月に対して京大グループは2006年12月であり、山中らの方が先んじていたことが判明している。
しかしながら、特許記載内容からも、ヒトiPS細胞はこの時点で作製されておらず、2007年7月に作製されたことが公表されている。
2011年8月現在、日本、アメリカ、ヨーロッパ等で特許が成立している。
バイエル社の樹立法は山中らの樹立法と異なる点もあるので、バイエル社の特許は方法を限定して部分的に認められる可能性もある。
同様のことは、アメリカの研究グループの方法についても当てはまる。
その後、バイエル薬品が出願していた特許はアメリカのベンチャー企業アイピエリアンに権利が移り、2010年イギリスで特許が成立した。
2011年2月1日、アイピエリアンが京都大に特許を無償譲渡し、京都大が同社に特許使用を許諾することで合意したことが発表され特許紛争は回避された。
iPS細胞樹立に対する世間の反応
iPS細胞樹立の成功により、ES細胞の持つ生命倫理的問題を回避することができるようになり、免疫拒絶の無い再生医療の実現に向けて大きな一歩となった。
2007年11月には宗教界からの評価の一例として、ローマ教皇庁(ローマ法王庁)の生命科学アカデミー所長のエリオ・スグレッチャ(英語版)司教(肩書きはいずれも当時のもの。なお、同司教は2010年11月に枢機卿に親任されている)は
「難病治療につながる技術を受精卵を破壊する過程を経ずに行えることになったことを賞賛する」
との趣旨の発表を行った。
またこの成功に対して、2007年11月23日に日本政府が5年間で70億円を支援することを決定。
さらに、山中は2010年4月より京都大学iPS細胞研究所長を務めている。
「成熟細胞が初期化され多能性をもつことの発見」 により、山中は2012年の ノーベル生理学・医学賞 を受賞した。
iPS細胞の課題
しかし、真の実用化までには、まだ課題がある。
癌化
マウスの実験において表面化した最大の懸念は、iPS細胞の癌化であった。
iPS細胞の分化能力を調べるためにiPS細胞をマウス胚盤胞へ導入した胚を偽妊娠マウスに着床させ、キメラマウスを作製したところ、およそ20%の個体において癌の形成が認められた。
これはES細胞を用いた同様の実験よりも有意に高い数値であった。
この原因は、iPS細胞を樹立するのに発癌関連遺伝子であるc-Mycを使用している点と、遺伝子導入の際に使用しているレトロウイルスは染色体内のランダムな位置に遺伝子を導入するため、元々染色体内にある遺伝子に変異が起こり、内在性発癌遺伝子の活性化を引き起こしやすい点が考えられた。
このため、iPS細胞を作出するのに、癌遺伝子を使わない手法の開発が多くのグループにより進められている。
2007年12月には、c-Mycを除くOct3/4・Sox2・Klf4の3因子だけでも、マウス・ヒトともにiPS細胞の樹立が可能であることが山中らによって示され、iPS細胞が癌化するのを抑えるのに成功した。
ほぼ同時にヤニッシュらのグループも同様の実験にマウスで成功している。
しかし、「作出効率が極めて低下する」との問題があり、効率を改善する手法の開発が進められている。
2011年6月9日、Oct3/4・Sox2・Klf4の3因子にglis1という遺伝子を加えることで、c-Mycを加えた時と同様の作製効率となる上に癌化するような不完全なiPS細胞の増殖も防ぐという画期的な研究が発表されている。
また、レトロウイルスを用いないでiPS細胞を作出する手法の開発も進められている。
慶應義塾大学医師の福田恵一らのグループではTリンパ球にセンダイウイルスを導入する方法を報告している。
2009年3月には、英エディンバラ大学の梶圭介グループリーダーらにより、ウイルスを使わないでiPS細胞を作成する方法が発表された。
倫理的問題
ES細胞において最大の問題となっていたのは、受精卵を破壊しなければES細胞を作成できないという倫理的問題であった。
iPS細胞はこの問題を解決することが期待されていたが、ここにきて新たな倫理的問題が浮上している。
2012年10月、京都大学の斎藤通紀教授らのグループがマウスにおいてiPS細胞から精子と卵子を作製し、それらを元に受精、出産に成功したと発表した。
これにより、不妊治療への応用の道が開かれた半面、「同性愛者間での妊娠・出産の是非」や、「同一人物の精子と卵子を受精させ、出産させる」ことが可能であるという倫理的問題が浮上している。
前者の「同性愛者間での妊娠・出産」に関しては各個人の価値観に基づく問題ともいえるが、後者の「同一人物の精子と卵子を受精させ、出産させること」に関してはクローン羊ドリーが誕生した時に騒がれたように、ある特定の人物を複数誕生させることができ、クローン人間同様に「iPS細胞の由来で生まれた人間」の権利が認められない、などの問題がある。
また、日本やアメリカなど主要国が「iPS細胞由来生殖細胞による受精を禁止」しても、これを禁止していない国ならば容易に可能であるということも問題に拍車をかけている。
これはiPS細胞が大学院生でも作製可能という容易さと、体細胞由来ということから生じた予期せぬ倫理問題であり、今後解決すべき必要があるといえる。
iPS細胞から組織への分化誘導
1981年にマウスES細胞、1998年にヒトES細胞が樹立されてから年月が経ち、定期的に脈打つ心筋細胞や軸索を持った神経細胞、インスリンを分泌する膵β細胞など、ES細胞からさまざまな種類の細胞を作り出すことに成功しているが、大部分はまだ細胞レベルの基礎研究であり、実際に移植した際の機能や組織補完能力についてはまだ良く分かっていない。
また、高度な機能と構造を持った組織や臓器レベル(心臓、脳、膵臓など)の再生は、実用化に程遠いのが実状である。
拒絶反応
従来はiPS細胞は、元になる細胞を提供した個体に戻しても拒絶反応は起こらないと考えられていたが、マウス実験ではiPS細胞でも拒絶反応が起こりうることが報告された。
しかしこの実験には問題があり、信憑性は定かではない。
現時点ではiPS細胞に対して免疫拒絶反応が起こったのかどうかは決着がついていない。
臨床応用へ向けての研究成果
これらの問題はあるものの、iPS細胞の基礎医学・創薬への応用は、将来多く報告されると思われる。
2007年12月:ヤニッシュらのグループにより、ヒトの鎌状赤血球症遺伝子を組み込んだモデルマウスの尾からiPS細胞を樹立した後、相同組換えにより原因遺伝子を野生型へと置き換え、造血幹細胞に分化させた後モデルマウスに移植するという、iPS細胞を利用した新たな遺伝子治療モデルが発表された。
2011年3月:東京大学教授の宮島篤らのチームが、マウス実験レベルながら、ランゲルハンス島の元になる細胞を培養する方法を開発し、iPS細胞をランゲルハンス島にすることに成功した。
このランゲルハンス島をマウスに移植することで、血糖値を低く保つことにも成功した。
これらの研究は2011年3月の日本再生医療学会で発表された。
2012年8月:京都大学iPS研究所、筑波大学などがALSの患者のiPS細胞から治療薬の候補物質を見つけ出すことに成功したと発表した。
2013年2月28日:理化学研究所と先端医療振興財団が世界で初めてiPS細胞を使った目の難病(加齢黄斑変性)の臨床研究の計画書を厚労省に提出、厚労省は3月27日に18人の専門家らが参加する『ヒト幹細胞臨床研究に関する審査委員会』を開催し、理化学研究所、先端医療振興財団が申請したiPS細胞を使った初の臨床研究計画について審査を始めた。
報道における語弊
iPS細胞を用いて臓器を初めとした人体の細胞の作成は着実に進んでおり、一部では実際に成果が出始めている。
メディアでは臓器細胞などの作成がiPS細胞によって初めて成された成果であるかのような報道がなされているが、これには語弊がある。
幹細胞と同等の能力を持つiPS細胞を作り出す技術と、幹細胞を臓器など他の細胞に変化させる技術は全く異なるものであり、幹細胞を人体の別の細胞に変化させる研究はiPS細胞の作成よりも遥かに以前から行われ、成果も出されていた。
iPS細胞作成の功績は他の細胞を作り出すための「素」をこれまでよりも容易かつ大量に得ることを可能にした点にある。
「iPS細胞」という名前は、山中教授自身が命名したもので、最初を小文字の「i」にしたのは、当時世界的に大流行していた米アップルの携帯音楽プレーヤーである『iPod』のように普及してほしいとの願いが込められている。

新緑キラキラ♪ posted by (C)エージロー
http://mainichi.jp/select/news/20121009mog00m040012000c.html
http://www3.nhk.or.jp/news/html/20121008/t10015593171000.html
ノーベル賞:医学生理学賞に山中氏 山中教授、田中耕一氏と語る
2012年10月09日
ノーベル医学生理学賞の受賞が決まった山中伸弥教授は8日夜、毎日新聞との単独インタビューに応じた。
02年にノーベル化学賞を受賞した田中耕一・島津製作所シニアフェローも電話会議システムで加わり、受賞の喜びや今後の研究について語り合った。
(聞き手は砂間裕之・毎日新聞大阪本社科学環境部長)
◇田中氏「研究者に遊び心必要」
◇山中氏「若手も私に質問して」
(Q)おめでとうございます。感想は‥‥

山中伸弥さん ノーベル医学・生理学賞を受賞♪ posted by (C)エージロー
こんばんは。行楽の秋、スポーツの秋、実りの秋、秋たけなわ。
今日の瀬戸内海は、山中教授のノーベル医学生理学賞受賞という偉業達成を祝うかのように、からっと天高く爽やかな日本晴れとなりました。
明日も良い一日でありますように。Good luck !!
◆「先生、細胞の塊が…」 山中氏、iPS成功への道のり - 2012年10月8日22時54分
http://digital.asahi.com/articles/TKY201210080332.html?ref=comkiji_txt_end_kjid_TKY201210080332
◆実用化待つ人へ「希望を持って」 山中教授が受賞会見
http://t.asahi.com/8c0k
◆〈今さら聞けない+〉iPS細胞の実用化
http://t.asahi.com/8ci6
◆【田中耕一】 in Wikipedia http://ja.wikipedia.org/wiki/%E7%94%B0%E4%B8%AD%E8%80%95%E4%B8%80
■iPS成功への道のり/超スピード受賞、評価の高さ示す【朝刊 特集面 型破り 結実】
http://www.asahi.com/20121009/pages/tokushu.html?ref=mail_1009_01#PageParts32172
■挫折こそ万能の父/山中教授の受賞会見 動画、一問一答も【朝刊 特集面 超人ヤマナカ】
http://www.asahi.com/20121009/pages/tokushu.html?ref=mail_1009_02#PageParts32173
■日本19人目、医学生理学は25年ぶり/研究費は民間中心、景気と学生減課題【朝刊 特集面 偉業 日本発】
http://www.asahi.com/20121009/pages/tokushu.html?ref=mail_1009_03#PageParts32886
ジャンル別一覧
人気のクチコミテーマ
-
-

- 闘病日記
- TFCC損傷 4回手術をしても治らなか…
- (2024-06-08 07:42:02)
-
-
-

- 入浴後の体重
- 2024/06/26(水)・「0・7減」(#^^…
- (2024-06-26 17:00:00)
-
-
-

- 活き活き健康講座
- GWも従業員の健康増進を応援する企業…
- (2024-05-08 12:34:07)
-
© Rakuten Group, Inc.