[実験開発] カテゴリの記事
全141件 (141件中 1-50件目)
-

生徒実験:蒸留・ペーパークロマトグラフィ・ろ過(蒸留は演示で)
毎年、1年生2単位の「化学基礎」初めの実験は「分離と生成:蒸留・ろ過・ペーパークロマトグラフィ」です。講師ですので毎年学校は違うので、設備、時数など事情が違います。今年の学校は県内偏差値40台の学校です。生徒はとても素直で毎日楽しく授業をさせてもらってます。これまで、生徒の学力??とは関係なく(偏差値60-70台も)実験準備と実施、レポートは以下のリンクでご覧ください。1学期の実験準備⑤蒸留・ペーパークロマトグラフィー・ろ過→2018.04.05ブログ生徒実験:蒸留・ペーパークロマトグラフィー・ろ過→2018.04.12ブログ生徒実験「分離と精製」生徒レポート→2019.04.19ブログさて、生徒実験のプリントです。A4サイズ両面で印刷、生徒の配ります。生徒実験(50分授業)の予定です。勤務校では、蒸留装置は1セットしかありません。そこで、①実験室の空いている実験台に蒸留装置をセットする。②生徒には、ペーパークロマトグラフィ・ろ過の実験を始める。③約10人を蒸留装置に呼んで、実際に蒸留しながら蒸留の注意事項を解説、メモを取らせる。時間的にゆとりがあります。その分、しっかり観察をしてもらい、理解を進めてもらいます。なにしろ、中間試験がすぐですから、、、
2023.05.01
コメント(0)
-

中和滴定「食酢の濃度を調べる」楽しく生徒実験
生徒実験で中和滴定「食酢の濃度を調べる」を行いました。現在の勤務校はあまり算数ができない生徒たちがいます。中和滴定の公式、acV=bc'V'の計算がすぐにできない生徒もいます。このような生徒たちに、中和滴定の実験を行うのですが、緊張感の中でも、中和滴定操作を楽しんでほしい。滴定の終点、「フェノールフタレインの淡赤色」競争がこの実験の中心です。実験操作に集中・夢中になってもらい、データの処理は後でしっかり行うことに。実験書は勤務校のT先生作成。食酢はあらかじめ10倍に希釈、水酸化ナトリウム水溶液は0.100mol/L(公正済み)を用意しました。板書は以下です。①最初にコニカルビーカー(3つ)に食酢溶液10mLをホールピペットとピペッターでとり、フェノールフタレイン溶液を2滴いれて、いったん作業中止。こんな感じで、操作させては説明を繰り返しました。②ビュレットに水酸化ナトリウムを入れさせます。順に操作させているので失敗なく、無事に準備終了。(どんな学校でも、よくある失敗はロートから水酸化ナトリウム溶液をあふれさせてしまうこと)さて滴定開始。1回目。真っ赤な終点のコニカルビーカーばかり。全員注目!「これはひどいよー!」運よく淡赤色になったビーカーを見せて「すばらしい!」と褒め褒め。生徒は「今度は私がやる」といって滴定が熱を帯び始めます(笑)。生徒は一生懸命。なかなかの盛り上がりでした。3回の滴定を終えたところで40分(50分授業)残りでガラス器具の水洗い、かたづけを行って終えました。
2023.02.16
コメント(0)
-

生徒実験:「化学反応における量的関係CaCO3とHCl」生徒のレポート
生徒実験:化学反応における量的関係→2022/12/4ブログで行った生徒実験のレポート(1クラス分28人)が提出されましたしたので、紹介します。《最も評価したレポート》評価のポイントは次の2点を主に行いました。①グラフが指導したようにかけているか②《発展》で過剰量のCaCO3を加えた時の予想と考えがしっかりかけているか②については物質量molを詳しく答えることは期待していなかったのですが、この生徒は詳しく書いてくれました。とても、完成されたレポートです。《その他の生徒のレポート28人》①グラフについて よいグラフ17名 データの打点なし1名、折れ線2名、 右端の打点からの外挿なし8名②《発展》過剰量のCaCO3を加えた時の説明 物質量も考慮して答えた6名、 物質量についての言及ないがHClの消費が書かれている3名 (ここまでを正答とした) CaCO3が飽和量を超えてしまい溶けきれなくなった16名 未記入3名化学反応の過剰量についての授業はしていませんでしたので、6名も言及してくれたことに驚き、喜んでいます。生徒を侮っていたかなぁ…
2022.12.06
コメント(0)
-

生徒実験:化学反応における量的関係
1年生化学基礎2単位(50分)2クラスを受け持っています。2学期は物質量(mol)を中間試験まで、その後、化学反応式を勉強します。そして、「化学反応における量的関係」までが期末試験の範囲です。教室で勉強した量的関係を実際に確認する実験を行いました。《生徒用プリント》※実験プリントは勤務校のT先生作成を使わせていただいています。※プリント中の赤・青文字は生徒のデータをもらって書き、私が考察を入れました。《板書・準備》生徒(一班4-3人)には木製実験箱にガラス器具、電子天秤(感量0.01g)を用意しました。黒板前の教師用机には6mol/L塩酸と炭酸カルシウムを並べて、各班に取りに来てもらいます。《実施・生徒の動き》説明10分、生徒の操作時間(ガラス器洗い、片付けまで)30分、電卓で計算・プリント整理10分でした。だいぶ実験がスムースにできるようになりました。なお、レポート提出は次の時間です。《生徒の間違えやすいところ》生徒は電子天秤を初めて使います。「RE-ZEROボタンをどのタイミングで使うか」を特に強調して注意する板書になりました。炭酸カルシウムを1-4gはかり取るときに、炭酸カルシウムだけの質量が必要なのですが、①生徒が「薬包紙+炭酸カルシウム」の質量をはかってしまうことを恐れたからです。 実際は板書のおかげで間違う生徒はいませんでした。②しかし、操作を間違えないようにマニュアル化すると、生徒は自分が何の質量をはかっているかわからなくなる これは、今後の実験説明と板書を工夫する必要がありますね。《関連した量的関係の実験》これまで勤務した各学校で行った「化学反応における量的関係」のリンクをいかに貼っておきますので生徒の理解度や実験への慣れによって少しづつ違うのでご検討ください。化学反応の量的関係;CaCO3とHClaqの反応→(理系3単位)2018/6/26ブログ文系2単位で化学反応の量的関係;CaCO3とHClaqの反応→2019/11/12ブログ文系2単位で化学反応の量的関係;生徒実験レポート提出→2019/11/27ブログ※このブログは「たくさんの生徒実験を準備から実施・レポートまで紹介し、各校の実情に合わせて改良していただく」ことを目指しています。たくさんの実験プリントを提供くださっている勤務校のT先生は、この趣旨を理解して、こころよく提供いただいています。
2022.12.04
コメント(0)
-

生徒実験2つ;理屈はともかく経験が大切
2学期に行った2つの生徒実験です。授業は化学基礎1年。現在の講義は「反応式の書き方」、「反応式と物質量」の項目です。県立高校で、一般にはランキングの低い高校ですが、生徒たちはとても人懐っこく、楽しく城業をしています。さて、実験は「反応式の書き方」とは関係ありませんが、たくさんの物質・薬品に触れさせ(経験を積ませ)、物質名や化学式が出てきたときに現物をイメージさせることをもくろんでいます。実験は①【ハロゲンの性質】10月実施②【濃硫酸と濃硝酸の性質】11月実施です。50分の実験時間です。テキストは同僚のT先生のもの。進行がスムースになるよう、内容もむりなく、生徒にぴったりのすぐれた実験テキストですので、そのまま載せます。②【濃硫酸と濃硝酸の性質】11月実施(上の写真) では、「危険な薬品」「有毒な気体」であることを注意したので、最初はおっかなびっくりの生徒たちでしたが、しだいにスムースに操作できるようになりました。生徒にとって、印象的だったものは2つ。(1)砂糖の脱水による炭化;次の授業で詳しく原理を説明しました(2)気体のにおい;ここでは二酸化窒素(すぐドラフトへ移させました)とアンモニアです 二酸化窒素は10月に実験した塩素ガスCl2のにおいと似ているので、すぐに塩素を思い出したようです。 アンモニアはかぎすぎて目が覚めた生徒がいましたが、具合が悪くなる生徒も出ずホッとしてます。においは記憶に残る。二酸化窒素をかいで、しっかり塩素を思い出してくれました。アンモニアはがっつり記憶されたことでしょう。塩素や二酸化窒素など有害気体のにおいを経験しておくのも、危険から身を守るうえで役に立つかな。これまで、授業と関連深い、しっかり理論で裏うちされた実験ばかり行ってきましたが、今回の実験のように、化学式や薬品名と物質をつなげる実験も重要だと思いました。生徒は経験不足です。たくさん経験を積ませたいと思います。
2022.11.18
コメント(0)
-
仮説:無極性溶媒は過冷却しない?!
凝固点降下の実験を検討していて「無極性溶媒は過冷却しない」という仮説を思いつきました。次の実験結果を見てください。①水=極性溶媒の冷却曲線緑の線が純水の冷却曲線です。https://plaza.rakuten.co.jp/cynqa2/diary/201904040000/②無極性=ベンゼン青の線がベンゼンの冷却曲線です。https://plaza.rakuten.co.jp/cynqa2/diary/201904080000/②無極性=シクロヘキサン青の冷却曲線がシクロヘキサンです。https://plaza.rakuten.co.jp/cynqa2/diary/201904020000/写真にあるような実験器具で、同じ条件で実験しました。純溶媒のベンゼンやシクロヘキサンでは過冷却が起こっていません。で、「無極性溶媒は過冷却しない」という仮説に思い至りました。ネット上に転がっている「過冷却」現象の解説は液体では分子運動しており、整列し結晶化するには「徐々に冷やしていくと、分子が固まらずにいつまでも動き続けることができます。凍るための引き金が引かれていないような状態です。」AMU冷熱「しかし熱力学的安定状態に至るにはある程度大きなエネルギーの山を超えなければなりません。高校化学でも出てくる活性化エネルギーと同じです。このエネルギーを超えきれない状態が速度論的安定です。速度論的安定は時間が経つか、エネルギーを与えれば熱力学的安定になります。」ヤフー知恵袋ベストアンサー以下の解説が一番しっくりいきました。「氷にならない理由は、分子配列が水と氷では異なるからです。水(液体)の分子が向きをかえて氷(結晶)としての配列にならなければなりません。そのためにはエネルギーが必要です。なぜなら、水分子は周囲の水分子と水素結合で結びついているからです。この水素結合をいったん切って向きを変え、水分子は再配列して氷になります。氷になったときは、水分子は周囲の水分子との間で再び水素結合をつくって安定化します。」Science Peripatosブログもう少し、私の仮説で過冷却に解釈を加えると極性溶媒の水は液体中では水分子の小集合(クラスター)を作っていて、氷のように巨大な結晶を作るように整列するには、クラスターを一度といて、再配列が必要となる。このクラスターをとくエネルギーを超えなければ氷にならない。無極性溶媒ならばクラスターを作りにくいので容易に凝固し、過冷却現象を起こしにくい。というぐあいです。さらに、いくつかの溶媒・条件で検証が必要ですがいががでしょう。また早稲田大学の研究トピックにという論文。早稲田大学理工学術院の平沢泉教授らの論文が紹介されていました。今や、どうすれば過冷却を起こさないかに注目されているようです。
2022.07.07
コメント(0)
-

生徒実験 炎色反応;色の表記について
久々に生徒実験を行いました。今年度は化学基礎1年2単位50分で偏差値45の高校で講師をしています。内容は、「基本操作と元素の確認」です。実験テキストは勤務校のT先生の作成したものを使いました。①メスシリンダー、試験管、駒込ピペットの扱い方②ガスバーナーの点火・消火③ヨウ素I2の検出(ヨウ素デンプン反応)、試験管の加熱④炎色反応⑤器具の洗い方を実験室で行いました。②ガスバーナーの扱いについて ほとんどの生徒たちは中学校でガスバーナーを扱った経験がありました。マッチも上手につかいます。④炎色反応について生徒たちはしっかり観察していたようですが、気になるのは色の表記です。視覚は人によって様々ですから、教科書や資料が生徒の勉強の指標になるでしょう。手元の資料で炎色反応の表記をまとめました。資料によりいくつか違いがあります。リチウムは赤、銅は青緑、ストロンチウムは深赤というところが定番かな。炎色反応の色や沈澱の色について、生徒はいろいろな表現をします。ピンク色、レモン色、オレンジ色、茶色などです。一般に化学ではモノの色は使いません。ピンクは淡赤色・赤白色、レモンは黄色、オレンジは橙色、茶は褐色となります。(橙色は英語でOrangeですがね)色の表記は、視覚の間隔を言葉で表現するので難しい。同じ色でも発光する色と反射色の違いは特に表現しがたい。
2022.05.13
コメント(0)
-

銅アンモニアレーヨンの合成2より繊維に近いものを作る;予備実験
銅アンモニアレーヨンの合成;予備実験 →2018/1/24ブログで以前予備実験を行いましたが、このとき「かなり粘る液体になりました。これを注射器ですって、硫酸水溶液に押し出します。結果は上の写真右です。ひも状のものも出来ましたが、なんだか、ミミズやウーパールーパーみたいなものができてしまいました。あまりに粘りが強く、ブチュっと出てしまい、スムースに出ませんでした。」となって満足のいくものができませんでした。同僚のA先生が再度試して太さ1mmほどのモノを作ることができました。前回は注射針を使わなかったった。今回は注射針を使いました。前回に比べてシュバイツァー試薬の粘土は低いので、注射針を使っても吸引できます。まとめの実験資料です。A先生の許可を得て示します。
2022.03.13
コメント(0)
-

「塩から弱塩基の遊離」…生徒実験できません(´;ω;`)ならば演示で
わが市ではついに300名近いコロナ感染者数となり過去最高です。化学平衡の生徒実験はあきらめました。演示実験の1つを企画しました。「弱塩基強酸の塩から弱塩基の遊離」実験です。塩化アンモニウムNH4Clに水酸化ナトリウムを加えるとNH3が発生するNH4+ + OH- ⇄ NH3 + H2Oの化学平衡を考えるのに刺激的(笑)な実験です。上の写真は一辺5㎝ほどのチャック付き袋に塩化アンモニウム(固体)を薬さじ小1ぱいを入れておきそこに、水酸化ナトリウム1粒を入れ、カシャカシャとシェイクします。すぐにアンモニアが発生。チャックを開ければ、例の強烈なにおいで確認できます。教室に数袋持って行って、生徒に塩化アンモニウムのみのにおい(無臭)を確認後、水酸化ナトリウムを1粒加えて、シャカシャカの後、匂いを確認。演示実験後はチャックをして、回収し、後で水を加えて溶液とします。微量で簡単、後始末も楽にできます。このチャック付き袋は、「モノタロウ」で安く大量に手に入ります。いろいろなサイズがあり、用途に応じて使い分けています。今の時期、生徒実験がままならず、刺激のない生徒には少しはいいかも!!?
2022.02.01
コメント(0)
-

きれいな塩化ナトリウム結晶を再結晶で作る-3日後の様子と作業
きれいな塩化ナトリウム結晶を再結晶で作る →2021/12/19ブログの経過報告です上記の記事では、12/17までの経緯を書きました。今回の経過報告は12/20までの結果を記します。3日間経過後、最大で一辺6mmくらいになりました。大小6つのシャーレから、形のいい結晶を取り出しシャーレからピペットで取り出した飽和水溶液に入れなおしました。また、アルミ箔でふたをしてしばらく放置します。蒸発しにくい、寒い環境下(15~夜間8℃)なので時間がかかります。大きくなったらまた報告します。
2021.12.20
コメント(0)
-

きれいな塩化ナトリウム結晶を再結晶で作る
CHASE氏の論文から水溶液から再結晶によって、塩化ナトリウムNaClの結晶を作るのは難しいです。それは、温度により溶解度が変わらないからです。飽和食塩水から水を蒸発させることで結晶を作るのですが、種結晶を糸でつるすと、にごったり、ボコボコした結晶しか得られません。糸のほこりが原因していると思われます。GIGAZINEによって塩の結晶づくりが紹介されていたので試してみました透明度が高い完璧な「塩の結晶」の作り方が3年かけて編み出される、その記録が公開中 - GIGAZINE元ネタはCHASEさんの論文でHow to Grow Sodium Chloride Crystals at Home冒頭の写真は彼の論文からとりました。できるだけ、論文に沿って実験を始めます。①飽和食塩水を作る室温20℃の実験室で、NaCl 45.4g を 純水 103g に溶解(NaClの溶解度は各温度だいたい37)スターラーにかけて、シャーレでふたをし4時間攪拌しました。元論文は加熱溶解して室温まで冷ますとありましたが、加熱しませんでした。②飽和溶液をろ過して、再結晶はじめる翌日いったん攪拌後、飽和溶液をろ過、2種のシャーレに入れて、アルミ箔でふたをして実験台下棚に保存しました。これで、水がゆっくり蒸発してきれいなNaCl結晶ができるでしょう。③再結晶の様子 24時間後(12/9・8:20)、結晶は出ていませんでした。夜間10℃くらいまで冷えるので、蒸発が遅いと思います。 5日後(12/14・12:00)、一つのシャーレに1mm以下の結晶が浮いていました。 さらに5日後(12/17・10:25)、たくさん結晶が出てきました。だいたい5mmくらいのきれいな結晶が2つ析出していました。しばらく置いておいて、少し育ったら拾い上げようと思います。今回は、ここまで。反省は、(1)加熱溶解して室温までさましたほうがよかった(2)冬場は温度が低いので蒸発が遅く、何日もかかった。 時期を選ぶか、温度の高い場所に静置すればよかった。今後、また経過を報告します。なお、これまで塩化ナトリウムの結晶は、岩塩を割って取り出していました。「岩塩かち割り」と塩化ナトリウム型結晶2017/7/29ブログ
2021.12.19
コメント(0)
-

コロイド溶液の生徒実験
やっと生徒実験が再開されました。しかし、1・2・3年生とも化学を受講しており、その生徒実験が目白押しで、実験室が満杯です。新しい生徒実験を用意してありますが、それもできません。そこで、やっと2年生で実施できた「コロイド溶液」の生徒実験の詳細をレポートします。[目的・準備・試薬][実験操作]実験操作は以上です。ここまで、40分かかりました。残りの時間は、後片付けに使います。以下は結果の記録と考察です。
2021.11.11
コメント(0)
-
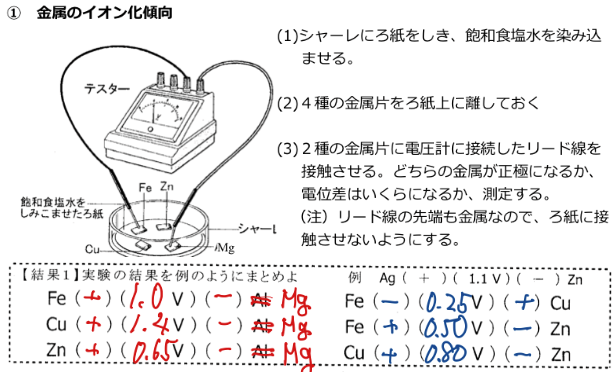
講義実験で「イオン化傾向と電池」を行いました=結果の記録
講義実験(演示)で「イオン化傾向と電池」を行います→2021/4/17ブログで準備していた、講義実験(演示)を1クラス終えました。結果を記録しておきます。①イオン化傾向と電位差プリントのAl(アルミニウム)はMg(マグネシウム)に変えました。電位差は【結果1】です。テスター(レンジ3v)ではかりました。電位差の大きさで、金属を並べるとMg>Zn>Fe>Cuとなって、イオン化列と同じになりました。②ボルタ電池鉛蓄電池でも使う予定の3mol/L希硫酸を使いました。以降、使うビーカーは100mLです。0.1mol/L希塩酸では、いくら何でも変化が見にくい(笑)。発生した水素がよく視認できます。泡が割れて、硫酸ミストが出るので、確認後、亜鉛板はすぐ取り出します。「亜鉛板と銅板を希硫酸中でつけると、これまで銅板上から水素が出なかったのに激しく水素が出た」「電子が亜鉛板から銅板に広がっていることをイメージして」「このままでは、動いている電子は何も仕事しない」「では導線を上につないで、途中にモーターをつないで電子に仕事させよう」こんな、展開をしています。起電力はモーターを付けない(無負荷)で0.95Vでした。③ダニエル電池ダニエル電池用素焼き容器;量産できました→2020/3/25ブログで作った素焼き容器を使います。モーターを回したのち、無負荷で起電力をはかります。起電力は1.1Vでした。③鉛蓄電池鉛板2枚を接触しないように3mol/L希硫酸につけます。そのままモーターにつないでも動かないことを見てもらった後、ハンドジェネレーターの+を鉛板が茶色になっているほう(酸化鉛Ⅳ)につなぎ、-を鉛板が灰色の方につないで充電します。モーターにつなぎ変えると、激しくモーターが回ります。すぐ止まるので、再度充電。これを繰り返して、充電・放電をわかってもらいます。起電力(無負荷)で2.0Vでした。コロナ下の不自由な演示実験でしたが、「化学はモノを相手にする」ともかく見てほしくて実施しました。
2021.04.21
コメント(0)
-

講義実験(演示)で「イオン化傾向と電池」を行います
コロナ下の実験はなかなか思い通りにできません。しかし、ものを見てもらわなければ「化学」の授業にはならないと思っているので、思い切って講義(演示)実験を予定しています。授業では、これらの項目にすでに触れています。①イオン化傾向 飽和食塩水上に並べた金属片の電位差をはかります。このようなやり方でもイオン化列の順に電位差が大きくなります。②ボルタ電池 教科書では「参考」として取り上げられますが、やはり触れておきたい。イオン化列と電位差について、亜鉛Znと水素Hから話しながら、硫酸ミストが発生する厄介なボルタ電池を早めに切り上げます。 とはいえ、硫酸中で銅板と亜鉛板を接触させると銅板上が水素H2が発生する様子を見せてから、導線で電子の流れを取り出して仕事させる(モーターを回す)ことをすると生徒の理解が深まります。③ダニエル電池 以前、作った小さな素焼きの容器を使います。ダニエル電池用素焼き容器、焼き上がり、電池を作ってみます→2020/2/21ブログ 起電力を測定、モーターを回してから、亜鉛板Znの代わりにマグネシウムリボンMgを二つ折りにしたものでも、起電力を測定、モーターを回します。起電力はもちろん上がりますし、モーターもよく回ります。④鉛蓄電池 充放電の操作を反応式を書きながら行います。起電力をはかり、モーターも回します。 このご時世ですから、次のような形で1. 実験室で行いますが、机の消毒、手指の消毒・マスク着用・指名された者以外の発声禁止2. 4人一班で計10班。うち2班の机で私が解説、指示しながら生徒が演示実験します。3. ホワイトボードにカメラで拡大画像を映しながら生徒全体が観察4. 授業終了後、手指の消毒 現在、教室に40人入って授業をしています。密な状態は変わりませんが、実験室は対面着席になるので、会話だけはできるだけ控えさせようと思います。
2021.04.17
コメント(0)
-

演示実験:塩化アンモニウムからアンモニアの遊離
2年生の授業は「化学平衡・電離平衡」をやってます。生徒実験はできません。しょうがないので、強塩基・弱酸の塩NH4ClからNH3の遊離の演示です。NH3は刺激臭なので遊離がわかりやすい。NH4Cl + NaOH → NH3 + NaCl + H2Oチャック付きのポリ袋に塩化アンモニウム適量、水酸化ナトリウム適量(上写真)を入れます。水溶液にしないのは、教室に持ち歩けて便利だから。水酸化ナトリウムを塩化アンモニウムの入った袋に投入して、よく混ぜます。呼吸器系の疾患を持つ生徒はかがないように、匂いを嗅ぐ際の注意を伝えて、回覧です。1,2袋回覧するので、必ず手洗いを指示。感染に注意して匂いを確認しました。匂いよりも、嗅いでいる生徒に対する周りの反応「大げさだ」「やらせだ」と楽しんでくれました。「どこで、この匂いに出会った?」と聞くと「キンカン」と答える生徒が多かった。いまだに、虫刺されに「キンカン」を使っているのですね。
2021.02.03
コメント(0)
-
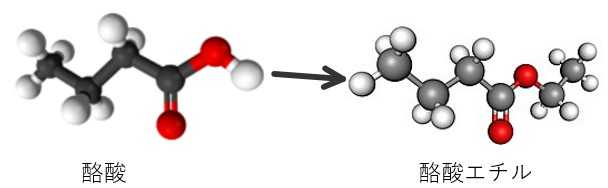
エステル合成_分液ろ紙_蒸れた靴下→パイナップルのにおい
悪臭の代表格は酪酸CH3CH2CH2COOHです。人の皮脂などにも含まれていて、10ppm程度でも感知できます。蒸れた靴下のにおいです。有機化学実験などでは酢酸エチルの合成がよく行われますが、CH3COOH+CH3CH2OH⇄CH3COOCH2CH3+H2O匂いの劇的変化を狙って酪酸から酪酸エチル=バナナ・パイナップルの果実香を合成する予備実験を試みました。ほんの少しの構造の変化でこんなにも匂いが変わる。さらに、「分液ろ紙」でエステルの分離を試みました。①(1) 酪酸を1.75~2.25mL3段階に試験管にとり、エタノールを1.75~2.25mL3段階に追加します。割合は直感で決めました。この時は酪酸のにおいが気持ち悪いのでドラフトで行いました。(2) 濃硫酸をそれぞれ0.5mL加えて70℃に加熱した湯浴に入れます。(3) 最も早く変化が表れたのがNo2の試験管でです。5分で酪酸エチルのにおいが出始め、白く濁ってきます。③ 放置すると2層に分かれました。他のものは均一のままでした。② 42分後(もうすでに反応平衡に達していました)飽和炭酸水素ナトリウム水溶液に試験管の中身を投入し、未反応の酪酸とエタノールを水層に。④よく見ると、2層に分かれていたので(1) No1はエーテルを加えて、分液ろ紙に。油層は通過して三角フラスコに。水層はろ紙上に残ります。(2) No2は油層が目立って多かったので、そのままろ過。(3) No3は油層がすくなかったが、そのままろ過。得られた油層はNo2が最大、エーテル層をとばしたNo1やNo3でも少量とれました。実験室はパイナップル臭であふれており、かえっていやになるほどでした。劇的な匂いの変化が面白いです。今回は、酪酸臭が嫌なのでエタノールを多めに入れました。後始末:反応に使った試験管は飽和炭酸水素ナトリウム溶液でよくすすいで酪酸を完全に洗い流します。これは有機実験に便利!分液ろ紙を試しました (2)→2020/12/15ブログ
2020.12.29
コメント(0)
-

ドルトン分圧実験器…エアコン圧力計を買ってみた
Monland エアコンフッ素化圧力計 デュアルゲージ固定周波数インバーターエアコン圧力計 カーホーム用 価格2205円(Amazon調べ)サイズ:180 * 130 * 40ミリメートル左青(-30)0~120psi (-)0~8.5kg/cm3 [0-8340hpa,8.2atm]右赤0~500psi 0~35kg/cm3 [0-34500hPa,34atm]演示実験:ドルトン分圧の法則実証→2018/12/8ブログで紹介した「M先生のドルトン分圧実験器」ですが、今やパーツがないようです。そこで、もう少し安価で簡単なものを作りたいと思い、あれこれ探してこの圧力計を購入してみました。問題点があります①左右の圧力目盛りが違うので、演示するときわかりにくい②パイプ接続用の径がわからず、ペットボトルにつなぐときに苦労しそう来年到着の予定です到着したらあれこれいじっていこうと思います
2020.12.22
コメント(0)
-

これは有機実験に便利!分液ろ紙を試しました
ADVANTECの分液ろ紙「2S」を使った、油層と水槽の分離です。これまで分液ロートを使ってきましたが、これはお手軽でよい。水層はろ紙上に、油層は通過します。上の写真は四塩化炭素2mlにヨウ素を溶解し純水4mlを加えて二層にし、ろ過したものです。9秒ほどでろ過が終わります。ろ紙上に水が残ります。ろ紙は水をはじくような様子。試験管にはろ紙を通過した四塩化炭素がたまりますが、見た目ですが水滴は落ちてきません。分液ろ紙は液相分離濾紙ともいいます。水と有機溶媒の分離を目的として作られました。強い撥水性を持っています。少しスムースな面とざらざらした面がありますが、どちらを上にしても同じような結果でした。モノタロウで9cm100枚1958円、7cm1190円で手軽な値段かと思います。分離が速いので、高校「有機化学」エステルの合成に使えそうです。エマルジョンの分離もできそうなので今後試していきます。
2020.12.15
コメント(2)
-

時計反応がうまくいかないときの対処法
はじめにこの反応の動画です。①0.05mol/LのKIO3と0.05mol/LのNaHSO3+デンプン溶液を混合②0.05mol/LのKIO3と0.02mol/LのNaHSO3+デンプン溶液を混合しています。急に変わるので、生徒に人気が高い。「化学反応の速さ」の授業では、生徒実験で行っている「時計反応」ですが、生徒実験がなかなかできないので演示実験にしました。こちらに、生徒実験のテキストと操作について詳しく上げてありますのでごらんください。生徒実験:化学反応の速さ(生徒実験)→2018/2/19ブログ同じように準備して、予備実験したところ、色がつかない。黒紫色になるはずなのに、無色透明のままでした。温度は18℃です。ヨウ素デンプン反応が時折トラブルを起こすのでこれかなと思ったので、ヨウ素液を入れると少し色がついてすぐ消えました。もしや、還元剤のNaHSO3が過剰かな、濃度についてはちゃんと作ったのに…そこで、用意したNaHSO3溶液を2倍希釈して、再度実験を行ったらしっかり黒紫色が付きました。KiO3が古く分解してしまったのでしょうか?新しい薬品を使えばこんなことはないのでしょうが、この時計反応では、ときおりうまくいかない(=いくら待っても黒紫色にならない)ことがあります。そんな時は、還元剤の濃度を少し薄めてやるか酸化剤のKIO3濃度を高めてやるとうまくいくと思います。
2020.11.12
コメント(0)
-

合成高分子化合物の実験を検討する③2液混合クリスタルレジンを試す
合成高分子化合物の生徒実験を模索しています。先に、光硬化性のクリスタルレジンを検討しました。合成高分子化合物の実験を検討する②光硬化性樹脂をの予備実験→2020/10/21ブログ反応機構については以下です。ラジカルによる連鎖反応です。合成高分子化合物の実験を検討する①光硬化性樹脂を試す→2020/10/20ブログ入手先ものせてあります。さて、今回は2液混合性樹脂の検討です。使用した2液混合クリスタルレジンは、日新レジンの製品です。主剤:ビスフェノールA型液状エポキシ樹脂200g硬化剤:変性脂環式ポリアミン100g硬化時間は24h-36hとなっています。実際の反応の様子は以下のリンクです。合成高分子化合物の実験を検討する④2液混合クリスタルレジン予備実験 →2020/10/24ブログ①ビスフェノールA型液状エポキシ樹脂上が構造式です。繰り返し単位n=0がほとんどの成分です。エポキシ環が両端についています。このエポキシ環の開環によって重合がすすみます。参考:https://www.cerij.or.jp/evaluation_document/yugai/25068_38_6.pdf②硬化剤:変性脂環式ポリアミンたくさんの種類がありますので、この製品にどれが使われているかわかりませんので、一例を取り上げます。下図「ラミロンC-260」です。参考:https://www.threebond.co.jp/ja/technical/technicalnews/pdf/tech32.pdf③重合反応2段階で起こります。(1)3級アミンの生成アミンのHによりエポキシが開環して、3級アミンとなります。(2)三級アミンが重合開始剤としてエポキシ樹脂が重合こうして、次々に重合が進みますが、□の一方にまだエポキシ環がありますのでこれが他のポリアミンと結合し、網目状に重合し、高分子化合物が成長し、硬化します。□の一方にもアミンがあるので、こちらでも、重合が進みます。実際に予備実験します。結果は次回。
2020.10.24
コメント(0)
-
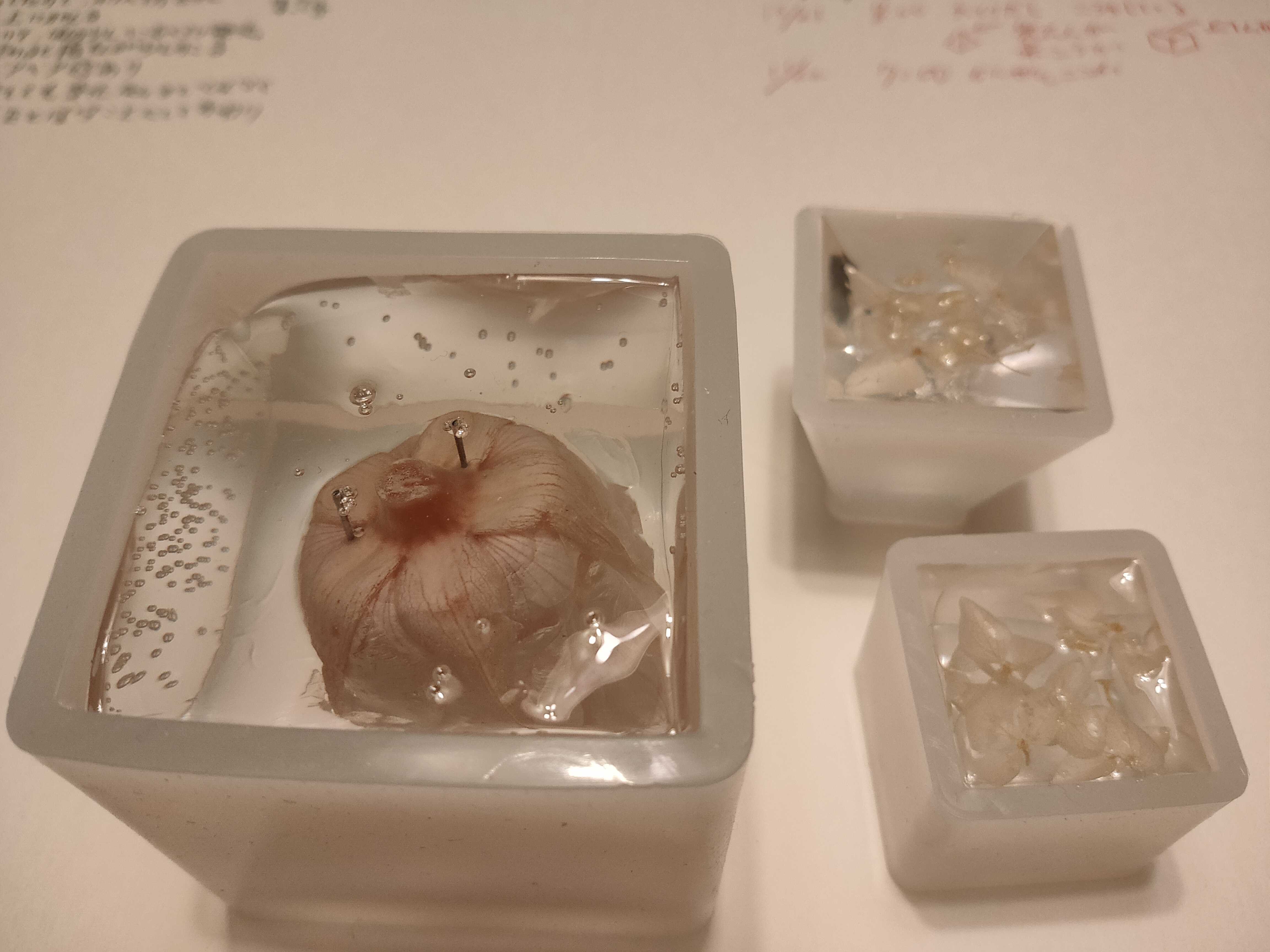
合成高分子化合物の実験を検討する④2液混合クリスタルレジン予備実験
今回は2液混合性樹脂を実際に試してみます。使用した2液混合クリスタルレジンは、日新レジンの製品です。主剤:ビスフェノールA型液状エポキシ樹脂200g硬化剤:変性脂環式ポリアミン100g硬化時間は24h-36hとなっています。反応機構については以下です。カチオン重合です。合成高分子化合物の実験を検討する③2液混合クリスタルレジンを試す→2020/10/24ブログ①2液の混合と流し込み主剤:硬化剤=2:1で混合します。主剤を94.1g、硬化剤48.0gを電子天秤で付属のポリカップに投入し、付属のプラスチックへらで3分ほどゆっくり攪拌します。体積は145mLでした。はじめは、白濁しましたが攪拌していくと、無色透明になりました。上の写真のようにシリコン樹脂の型(2020/10/20ブログ)に流し込みます。大きな型は5x5x5㎝で、余った混合液は小さな型に流し込んで145mLを使い切りました。封入したものは、「ユザワヤ」で購入した、ドライフラワーです(ピンクのバラと白色のカスミソウ)バラはレジンの中でゆすって花弁の間の空気を抜きました。その後、反転してまち針で中に沈ませて、そのまま硬化させます。匂いや発熱はあまりなく、室温15-17℃で室内に放置します。時間とともに、大型の型の方で枠表面に気泡が発生しました。硬化温度が低いか、型のよごれが原因だと思います。②硬化後17時間30分経ったところで、表面が固まったので取り出しました。大型のほうは完全に硬化していたのですが、小型の2つは写真のように、型の底面がまだ硬化していませんでした。硬化時間は取説に従ったほうがよかったと反省してます。赤みがかった光源で撮影したので、色は正しく伝わりませんが、レジンによる色の変化はありませんでした。ただ、大型のものでは横面に気泡がめだちます。小型は気泡もなくきれいにできていますが、底面(写真では上)が未硬化で形が崩れてしまっています。③生徒実験利用について(1)きれいな作品ができます。生徒の満足度も高いでしょう。(2)硬化に時間がかかります。実験後1日以上かけて結果が出ます。(3)したがって小さな型をたくさん用意する必要があります。シリコン樹脂のチャーム用型が売られていますので利用できます。(4)昆虫標本を封入するのに適しています。生徒閲覧用にいくつか作るといいかもしれません。合成高分子化合物の生徒実験を模索しています。先に、光硬化性のクリスタルレジンを検討しました。合成高分子化合物の実験を検討する②光硬化性樹脂をの予備実験→2020/10/21ブログ反応機構については以下です。ラジカルによる連鎖反応です。合成高分子化合物の実験を検討する①光硬化性樹脂を試す→2020/10/20ブログ入手先ものせてあります。
2020.10.24
コメント(0)
-

合成高分子化合物の実験を検討する②光硬化性樹脂をの予備実験
(色合いは白熱灯色蛍光灯下の撮影のため茶色だが、実際は赤褐色)クラフト用の光硬化性樹脂を合成高分子化合物の実験に使えないかと検討しています。上の写真は、テストで作ってみた葉脈標本の封入物です。合成高分子化合物の実験を検討する①光硬化性樹脂を試す→2020/10/20ブログで材料と反応を紹介しましたが、実際に実験してみます。【準備と材料】①UVレジン液(Resil)65mL→詳しくは2020/10/20ブログ②豆腐パッケージ6x6cm(型枠用)③封入用葉脈標本(赤染色)→手芸用品「ユザワヤ」で10枚入り200円弱で購入④太陽光の紫外線で硬化させる。念のため、クラフト用の紫外線光源(下写真)を用意した。【反応環境】 10/20 10:10 気温17.7℃ 時折日がさす、薄曇り【作成】10:30 レジン下層(高さ3mmほど)投入13.9g、色はごく薄い紫色で匂いはほぼなし ガラス窓越しで外光をあてる。太陽が直接当たらないようにする。10:41 針で刺すと少しへこむくらい硬化した。この間体温程度の発熱 葉脈標本を乗せる。10:50 その上にレジンを7.7g追加して封入。外光をあてる。11:08 追加層が針で刺すと少しへこむくらい硬化した。10:30 指で触ると指紋が少し残るので、このまま外光下に放置。13:05 少しべたべたした感じが残る。13:15 クラフト用の紫外線光源を2分照射、べたべたした感じは残る。10/2116:00 べたべたした感じは減ったがまだ残っている。可塑剤だろうか?【作成と完成品の評価】①型に流し込むとき気泡が混入する。粘度が高いので気泡を取り除くのが難しい。②封入物の変色(赤→赤褐色)がある。③短時間で硬化して完成品を持ち帰ることができるが、 今回のような大きめの作品はべたべた感が残るので、 アクセサリーサイズの小さい作品を作るといいと思う④明るい外光で硬化する。 薄曇りでも硬化するので、紫外線光源を用意しなくてもいい。試した結果は以上です。次回は2液混合型の合成樹脂を試してみます。
2020.10.21
コメント(0)
-

合成高分子化合物の実験を検討する①光硬化性樹脂を試す
「合成高分子化合物」において二重結合の付加でモノマーからポリマーになる反応について生徒実験を検討しています。 ①二重結合の付加反応を理解する ②ポリマー化で物質の状態がどう変わるか実感していもらう ③きれいな作品を作り、生徒に満足と興味を持ってもらう ④簡単に実験できるをめざして、実験を検討します。2種類のレジンを購入しました。1剤でUV硬化するものと2剤混合で硬化するものです。今回は1剤でUV硬化するするものを検討します。この製品の成分は「アクリレートプレポリマー」となっています。詳しくわかりませんがメタクリル酸メチルのオリゴマー(重合度の低いもの)と開始剤が混合しているものと思われます。そこで、メタクリル酸メチルの反応を紹介します。①光重合の例私もアクリル板工作で使うポリメタクリル酸メチルはこの仲間です。メタクリル酸メチルは2重結合により、重合します。開始剤は紫外線で励起されラジカルとなった22-ジメトキシ-1,2-ジフェニルエタン-1-オンなどです。(下図BDK)このほかに、開始剤としては次のようなものがあります。上図MMMPやBDMPはより長波長の紫外線でラジカル化しますので、これを使っているかもしれません。参考資料:㈱DJKよりhttp://www.djklab.com/parts/service/pdf/hikari-radical-1.pdf次回実際にテストしてみます。UVレジン液 大容量 UV-LED Resill レジル ハード & クリア 65g 日本製 高品質 クラフトアレンジ 送料無料価格:1000円(税込、送料無料) (2020/10/10時点)楽天で購入2020/10/10 現在価格また、2液混合型は日新レジンから販売されています。【期間限定!ポイント10倍中!10月11日1:59まで!】日新レジン クリスタルレジン 300gセット価格:2915円(税込、送料別) (2020/10/10時点)楽天で購入2020/10/10 現在価格シリコンの型が安く売られていますので、以下を参考にしてください。シリコンモールドはここにいろいろな型を売ってます
2020.10.20
コメント(0)
-

ブラウン運動を簡単に見ることができます
透過型顕微鏡でブラウン運動を簡単に見ることができます。分散媒;水、分散質;ユニポスカでコロイド溶液を作ります。透過型顕微鏡(限外顕微鏡でなくてOK)を用意します。<やり方>1.スライドガラスの中央ににユニポスカ(今回は赤です)をちょんと付けます。2.水を一滴垂らして、カバーガラスをかけます。3.顕微鏡を400倍にセットして観察します。以上で3分ほどで観察できます。上の動画は、スマホ(iPhoneX)で撮りました。接眼レンズにスマホのレンズをくっつけてスマホ画面で確認しながら撮影します。オートフォーカスなのでそこそこきれいな画像が取れます。上の動画はAviUtilで編集、音楽は「甘茶工房」●URL⇒ https://amachamusic.chagasi.com/著作権フリーの音楽を使わせていただいてます。感謝です。
2020.09.30
コメント(0)
-

浸透圧実験器をみつけて…地味ですが演示実験
コロナ下で実験室での生徒実験ができません。そこで、できるだけ教室で演示実験を見せます。浸透圧の授業です。実験室の棚に使われていない「浸透圧実験器」を見つけましたので、①一方に純水、一方にショ糖1mol/L水溶液を入れて②平均26-7℃の室温で約8時間放置すると、上の右写真のようになりました。なんとも、地味な演示です。変化が遅くて、結果しか見せることができません。物質を相手にする勉強ですから、地味でもできるだけたくさん見せたいと思います。どこの学校にもあり、あまり使われていない「浸透圧実験器」を発掘しましょう。
2020.09.11
コメント(0)
-

ダニエル電池用素焼き容器;量産できました
2つの量産型素焼き容器 左;すべて素焼き 右;アクリル円筒に素焼き板をつけた容器ダニエル電池用素焼き容器を焼きました→2020/2/18ブログダニエル電池用素焼き容器、焼き上がり、電池を作ってみます→2020/2/18ブログ100mLのビーカーでダニエル電池を構成できるよう、小さな素焼き容器を作ってテストしています。だいぶ、作り慣れてきたので生徒実験用に素焼き容器12個を量産していましたが、やっとできました。これで、生徒実験に使える素焼き容器が準備できました。作り方の概要は①陶芸用粘土を厚さ5mm以下に伸ばして板を作る②外径4cmのアクリル棒に乗せて円筒部分を作り、はがして…③②に、粘土で作った側板と底板を、 接着面に水を少し足して歯ブラシでチョンチョンと凸凹をつけ棒て 貼り付けける④接着面の粘土を手で伸ばして、密着させる⑤カッターではみ出した粘土を整形⑥新聞紙の上で5日乾燥⑦電気炉に入れて、常温から900〜1000℃を目指して加熱⑧900℃になってから1時間加熱を続け、電源切って放冷⑨翌日には冷えているので、取り出して完成また、アクリル棒を高さ5cmに切り、半分にして底にアクリル板、側板に上で作った素焼き板をグルーガンで貼り付けて、内部が見えるようにしたものを作りました。こちらの方が簡単で短時間でできました。(冒頭の写真右)
2020.03.25
コメント(0)
-

ダニエル電池28時間連続稼働でダウン→どうして?
ダニエル電池素焼き容器、長時間モーターを回せました→2020/2/20ブログダニエル電池素焼き容器、焼き上がり、電池を作る→2020/2/19ブログ一昨日来、28時間連続ソーラーモータを回転させることができました。その、ダニエル電池内容物を確認しました。①電極銅表面にはきれいに銅が析出していました。亜鉛は黒くなり(銅だとおもいます)、液面についていた亜鉛板は溶け落ちています。その結果、電池として働らかなくなったようです。②電解液左はビーカー内の硫酸銅(Ⅱ)水溶液(開始時1.0mol/L)。→開始時に比べてとても薄くなりました。右は素焼き容器内の硫酸亜鉛水溶液(開始時0.50mil/L)です。→底に沈殿が出ています。黒い亜鉛金属と銅だと思われます。→溶液は無色透明です。→濃アンモニア水を滴下(最終10mLまで)しました。 水酸化亜鉛の白い沈澱が出た後、銅イオンの混入を示す、青色に変わりました。かなり、素焼き板を通じて銅イオンの侵入があるようです。今回の実験で、ダニエル電池はスゴイ!と再評価しました。今回はヒラヒラの薄い亜鉛板を使いましたので、28時間しか持ちませんでしたが厚い亜鉛板を使って、もう一度、丁寧に実験してみようとおもいます。
2020.02.21
コメント(0)
-

ダニエル電池素焼き容器、長時間モーターを回せました
昨日、14:15、ソーラーモーターにつないで動作させた粘土から作った素焼き容器のダニエル電池ですが、ダニエル電池素焼き容器、焼き上がり、電池を作る→2020/2/19ブログ(硫酸亜鉛0.5mol/L、硫酸銅(Ⅱ)水溶液1.0mol/Lで作っています)本日の18:12にモーターが止まりました。実に、28時間連続動作しました。①実験開始時2/19 14:14無負荷時(モーターをつながない)電圧1.14V、電流(測れませんでしたのですぐ外しました)負荷時(モーターをつないだとき)電圧0.32Vモーターは勢い良く回っています。(電流を測れないのが残念)②今朝の様子2/20 8:40負荷時電圧:0.31V(8:40)-0.30V(11:00)-0.32V(11:45)( )内は時刻です③電極の様子いったん、中断し電極の様子を見ます。亜鉛版はすっかり溶けています。また、液に浸かっていた部分は黒くなっています。素焼き版を通過した銅イオンが銅粒子として析出したのかもしれません。もともと、実験室にあった薄くて古いものを使ったので先端がとけおちて、素焼き容器の底に黒く残っていました。銅板表面はきれいに銅が析出していました。硫酸銅水溶液はだいぶ青色が薄くなった気がします。③放電再開11:48負荷時電圧:0.34V(11;48)-0.36V(12:15)-0.38V(12:32)この後、電圧は0.38Vで安定していましたので、しばらく放置していました。そして、18:12分、28時間後に亜鉛板がとけ落ちて、モーターが止まりました。電圧:0.03V素焼き版作りから、電池の耐久試験まで、面白い実験でした。これまでは、授業や実験で5分くらい動作させて片付けていましたがダニエル電池は意外に実用的な電池だと感じました。亜鉛板表面の黒い析出物は銅だと思いますが、これはしっかり検証したい。また、素焼き板を銅イオンがゆっくり通過すると思いますが、これについても追実験をしてみたいと思います。
2020.02.20
コメント(0)
-

ダニエル電池用素焼き容器、焼き上がり、電池を作ってみます
ダニエル電池用素焼き容器を粘土から作る→2020/2/10ブログダニエル電池用素焼き容器を焼きました→2020/2/18ブログ準備してきましたダニエル電池用素焼き容器が焼き上がりました。昨日980℃になってから90分加熱して、放冷し今朝冷えたところで取り出しました。きれいにできましたが、収縮があまりなく、100mLビーカーにははいりませんでした。元の、粘土の色は黒っぽかったのですが、焼き上がりは明るいレンガのような出来でした。容器の平面部の厚さは3mmでした。これを、使ってダニエル電池を作り、性能をみてみます。200mLビーカーにはCuSO4aq(1.0mol/L)80mL,素焼き容器にはZnSO4aq(0.50mol/L)35mLを入れました。これに、2x5cmの亜鉛版と銅板を入れて、素焼き容器の端にできるだけ電極版が近くなるようワニ口クリップでとめます。最適濃度は下の論文にあり、CuSO4aqは2.0mol/L、ZnSO4aqは0.50mol/Lと報告されていましたが、手持ちの溶液で電池を作りました。高性能ダニエル電池ー電解質溶液の最適濃度ー(浜松北高)物理・化学部化学班報告電流計をつないでみましたが、100mAでは振れず、当然だけど1Aでも触れません。ただ、1Aの電流計につないだところ、ソーラーモーターがよく回転したので、電流計を外し、電圧計のみ接続して様子を見ました。室温15℃で実験開始から45分以上、0.32Vを維持し、モーターも変わりなく回転していました。(ここで装置を放置し、帰りました)あとは明日朝、電圧、モーターの回転、溶液の様子を確認したいと思います。
2020.02.19
コメント(0)
-

ダニエル電池用素焼き容器を焼きました
ダニエル電池用素焼き容器を粘土から作る→2020/2/10ブログで、整形、乾燥させていた粘土を焼きました。①形を整える柔らかな粘土なので、自重でそこがゆがんでしまいましたので、百均で買ってきたルーターで削り形を整えます。特に底の部分のふくらみを取りました。②900-1000℃で素焼きする小さな、低出力の電気炉なので時間がかりました。1000℃で90分素焼きするよう、購入した粘土には書いてあったので、1000℃目指して加熱します。13:10(温度10℃):石膏ボードにセラミックシート敷き、底を下にして過熱を始めました。15:30(温度850℃)-16:15(温度980℃)-16:30(温度980℃)-17:00(温度985℃)1000℃になりませんでしたので、ここでやめました。「素焼きだから、こんなもんでいいだろう」といういい加減さです。電源を17:00(985℃)で切り、あとはふたを開けずに放冷しました。明日、できばえを確認します。
2020.02.18
コメント(0)
-

ダニエル電池用素焼き容器を粘土から作る
ダニエル電池の授業ではシャーレとセロファンを使った簡単なもので実験してきました。テキトー電池:ダニエル電池→2017/10/10ブログしかし、同僚は素焼きの容器のダニエル電池を使いたいようです。教材会社のカタログは以下です。NARIKAKENIS高いんですよ。そこで、生徒用素焼き半円筒容器を作ってみることにしました。粘土は信楽の手びねり土を買いました。4kgで送料込み1150円でした。Amazonや楽天で探しましたが、この直販が一番安かった。まったくの素人ですが、学校に小さな電気炉があるので、ともかく作ってみます。この粘土は80メッシュ、焼成温度1200-1250℃で収縮率11-12%です。そこで、100mLビーカーにちょうど入るよう50mLビーカー外側に5mm厚の粘土板をまいて作ります。均一に5mm厚に伸ばして7.5㎝の正方形にカットします。普通のカッターと定規を使いました。これを50mLビーカーに巻き付けるとちょうど半分の雨樋状になります。これに合わせて、半円筒の側面と底面をカットして、接着します。接着面は歯ブラシでツンツンして細かい凸凹をつけ、水で濡らしてしっかりつなぎます。内側から細い粘土紐で内張しました。購入した粘土200gほど使って、半円筒容器2つ、残りは板にしました。2/6昼ごろ完成。これから1週間乾燥させます。電気炉で1000℃弱、90分焼いてみる予定です。
2020.02.10
コメント(0)
-

中和滴定「食酢の濃度を調べる」生徒のレポート
中和滴定「食酢の濃度を調べる」生徒実験→2020/2/4ブログの生徒レポートが1クラスですが提出されましたので、実験の検証を行います。《生徒の測定》実験は4人一班で行います宇。協力して、①食酢の10倍希釈②ビュレットにNaOH水溶液準備をします。その後、一人ずつ①希釈した食酢をホールピペットでコニカルビーカーにとる。②ビュレットで滴定4つデータを取り、大きく外れた滴定値を除外して平均し、次の「考察」を行います。①反応式を記す②希釈した食酢のモル濃度を算出③食酢のモル濃度を算出④食酢の%濃度を算出⑤共洗いの目的を説明する外れたデータを含めて、滴定値の分布です。《濃度の計算②-④》縦軸は測定回数、横軸は1.03mol/Lの水酸化ナトリウム滴下量です。表は、食酢%濃度の分布です。予備実験では滴下量平均6.82mL、食酢の濃度0.702mol/L、4.21%です。生徒は水酸化ナトリウム溶液を過剰に入れてしまう傾向があるので、滴下量が多めになります。そこで、食酢濃度が高めになりますが、生徒実験として許容範囲だと思っています。ただし、有効数字が2桁で計算してしまう生徒が1割強みられました。事後指導が必要です。《「共洗い」の説明》次は、典型的な「考察」です。滴定・計算ともよく書いています。しかし、⑤の共洗いの理由、について不十分だと考えています。間違いはないのですが、「どう変わるのか」を書いてほしい。内部の水滴を除くのが共洗いなのだからもし、水滴があったなら、濃度がどう変化するか、もう一歩踏み込んで考えてほしい。このあたりは、生徒が茶を濁すている感じがします。
2020.02.09
コメント(0)
-

中和滴定「食酢の濃度を調べる」生徒実験
中和滴定「食酢の濃度を調べる」の生徒実験を行いました。右はプロジェクターで注意事項を映しながら事前の説明をしました。以下の準備を事前に行っています。中和滴定の予備実験2→2020/02/03ブログ中和滴定の授業と予備実験→2020/01/31ブログ≪時間配分≫50分の授業時間です。生徒には、早めに集まるようお願いして、チャイムと同時に説明を始めました。説明15分、実験35分でした。実験中は実習助手と私で、班を回ってとまどわないように援助しました。片付け、器具の洗浄まで行って、多くの班が55分かかりました。(休み時間にかかりました)が、説明は先週にも行っており、「実験テキストでイメージトレーニングしておいで」と指示しています。事前の説明は10分でいいかなぁ。もう1クラス実験しますので、その時に活かします。≪生徒の実験≫非常に丁寧でした。文系の生徒ではありますが、丁寧に実験してくれるのでありがたいです。器具の破損もありませんでした。失敗ももちろんあります。・10倍に希釈した食酢を滴定せず、原液を滴定した。 これは、うっかりですね・ビュレットの読み間違いが2例ありました。 ビュレットの目盛りは0mLから始まります。例えば0.40mLと読むところを、下の目盛りから読んで、1.60mLと読んだ わざわざビュレットの全量50mLから引き算して、49.60mLと記録した(何を考えたか私には理解ができません)・フェノールフタレイン滴下を忘れた班はありませんでした。 毎年、忘れる生徒がいますので、しつこくいいます生徒の失敗は生徒実験を指導するためにとても役に立ちます。明日、もう1クラス実験しますので、他に失敗があれば、このブログを編集して紹介します。
2020.02.04
コメント(0)
-
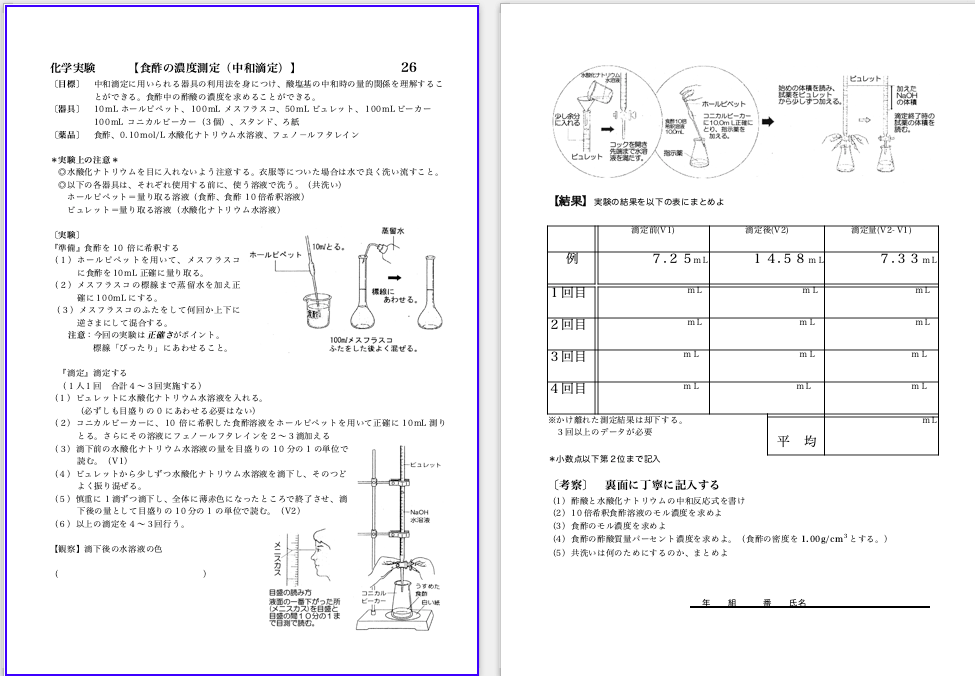
中和滴定の予備実験2
今週から文系2クラスで「食酢の濃度測定(中和滴定)」を行います。中和滴定の授業と予備実験→2020/1/31ブログで紹介しましたように授業で生徒に講義して上で実験します。毎年、理系・文系で同じ実験書を使っています。予備実験は実習助手の先生と行い、ビデオを撮りながら、ちょうど50分かかりました。ビデオを撮らないと30分くらいです。ホールピペットは2本。食酢希釈用と滴定用に10.00mLを用意しました。食酢用と廃液用に100mLビーカーが入れてあります。少し、指示薬の赤が強いです。半滴過剰に入れました。正確に10倍に希釈した食酢10,00mLについて0.1031mol/L水酸化ナトリウム水溶液で4回滴定を行い、6.79mL,7.02mL,6.82mL,6.86mLの滴定値を得ました。このうち7.02mLを除いて、平均値6,82mLを使って10倍に希釈した食酢の濃度は0.0702mol/L元の食酢濃度は0.702mol/Lで質量%濃度は4.21%でした。一昨年、理系で行った予備実験ー生徒レポートまでのリンクです。中和滴定の予備実験→2018/9/16ブログ生徒実験:中和滴定を実施→2018/9/18ブログ生徒実験:中和滴定のレポート→2018/9/21ブログ
2020.02.03
コメント(0)
-
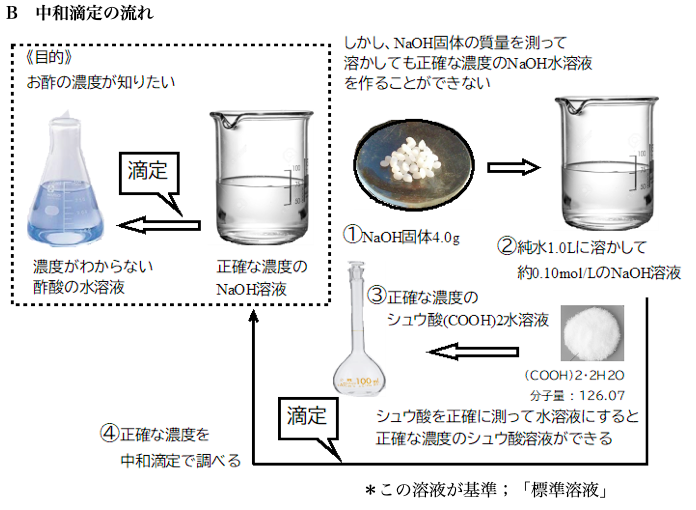
中和滴定の授業と予備実験
文系2単位化学で「中和滴定」の授業をすすめています。①中和反応の量的関係 演習を含めて終わりました。②水酸化ナトリウムの潮解性などの性質③シュウ酸標準溶液④中和滴定で用いる器具⑤食酢中の酢酸濃度を調べる生徒実験 来週初めの生徒実験にむけて授業しました。実験の目的をしっかり示して、その周辺の水酸化ナトリウムの性質やシュウ酸標準溶液の解説を上の図を使って行いました。実験プリントです。はじめに、ホールピペット、ビュレットを「共洗い」し、食酢のメスフラスコを使った10倍希釈を行います。その後、実験班4人全員にホールピペットとビュレット操作をしてもらいたいので4回滴定を繰り返してもらいます。50分の授業で毎年ぎりぎり終わらせていますが、生徒の実験全体に対するイメージがしっかりしていないとうまくいかないと思いましたのでビデオを編集しました。予備実験しながら撮影しましたので、ビュレットの下にビーカーを置き忘れなどミスが多い、中和滴定している様子がない、など十分ではありませんが、授業で補いながら見せました。実際の様子やレポートはまた報告します。
2020.01.31
コメント(0)
-
3学期の授業がはじまり、今年も、「万能pH指示薬でレインボー」
3学期の授業が始まりました。文系2単位を担当しているので、3学期は「酸と塩基」「酸化還元反応」となかなか進めません(週2時間じゃねぇ.....)シラバスの一部です。2時間で「酸・塩基」を終え、次回から「pHの定義・計算」です。対数にも少し触れます。味気ないので今年も「万能pH試験薬でレインボー」の演示実験します。pH指示薬は「pHの測定」のところで扱うのでいい機会です。万能pH指示薬でレインボー→2018/8/29ブログ準備・反応のさせ方など上のリンクをクリックしてたどってください。さて、演示実験の予備実験です。はじめは、さっと上のブログを読んで、チャチャっと準備しちゃおう!なんてのりで、ごう慢に始めたのですが、「1年前の私は他人」でして二酸化炭素の泡を吹きださせて、実験台を汚すは、溶液全体が黄色になってしまうはで、時間ばかりとってしまいました。丁寧に、かつ謙虚に自分が書いたブログ通りにやればできる。その結果です。もう少し時間を置けば、青紫が減って青・緑・黄色が広がるのですが、次回は早めに準備することにして、予備実験終了です。炭酸ナトリウムと塩酸の反応なのですが、あわてて、実験する→塩酸をゆっくり滴下しないで、勢いよく加えた記憶を頼りに実験する→塩酸の濃度を適当に、あるもので行ったという乱暴な実験は危ないし、失敗して余計な時間も使う反省してます。ゴーマンでした。
2020.01.15
コメント(0)
-

2年理系「生徒実験:ファラデー定数を求める」の予備実験
2年理系「生徒実験:ファラデー定数を求める」の予備実験をお手伝いしました。今年は文系生徒だけ教えていますが、製作した定電流電源の使い方を中心に予備実験しました。①はじめに11台の定電流電源を校正します。1年に2回しか使わない装置です。念のため、校正しておきます。アナログ電流計につないで(直結です。詳しくは下のリンクをご覧ください)、電源の電流計とアナログ電流系を比較します。1台だけ1A流れない電源があったので、電源のポテンショメータを回して1Aにしました。②さて実験です。実験プリントから③実際の操作です。・銅板をサンドペーパーでしっかり磨き、純水で洗ってから、水分をよく拭き取って、それぞれの質量を精密電子天秤ではかっておきます。・割り箸に輪ゴムで固定します。・電源を入れて、わに口クリップで銅板につなぎます。・実験前から1mol/LCuSO4aqをビーカーに入れて60℃に温めておきます。 電熱器にステンレストレイをのせたウオーターバスにビーカーを並べておきます。・ここまで準備が整ったら、温めたCuSO4aqを取りにいって、ストップウオッチを使いながら10分前後電気分解します。・この間、1分おきに電流値を記録します。定電流電源とはいえ、最大0.05Aくらいは変動しますので、測定した電流の平均値を使うためです(平均1.038Aでした)・ストップウォッチを見ながら、時間がきたら割り箸ごとビーカーから抜きます。(601秒でした)・割り箸につけたまま、純水の入ったビーカーでゆるゆると洗います。この時、陽極から銅の粉が落ちますが、その質量は誤差範囲なので気にすることがないことがわかっています。・電極の端を机の上においた濾紙でそっとトントンして、水分を落としてから、アセトンの入ったビーカー中でゆらゆら揺らします。・電極の端を机の上においた濾紙でそっとトントンして、アセトンを落としてから、ヘアドライアーの温風で乾燥させます。・銅板を割り箸から外します。電気分解した表面を触らないようにします。特に陽極は触ると銅の粉が手につきます。陽極の手についた銅粉により誤差が大きくなります。・それぞれの質量を測定します。以上の結果をメモしたものが以下です。実験時間は23分でした。これでファラデー定数を計算するのですが、陰極:9479C 誤差0.83%陽極:9617C 誤差0.34% でした。生徒実験ではどんな結果になるかは下のリンクをクリックしてください。誤差の少ない、なかなかいい実験です。定電流電源装置を一台1500円で作ります→定電流電源の材料について(2017/9/5ブログ)電気分解用1500円定電流装置の配線と設定→配線と調整について(2017/9/6ブログ)実験:ファラデー定数を求める→予備実験(2017/9/8ブログ)ファラでーの法則生徒実験;電流計校正と予備実験→電流計校正方法(2017/10/28ブログ)生徒実験「ファラデー定数を求める」実施しました→生徒実験(2017/11/1ブログ)生徒実験「ファラデー定数を検証する」レポートから→生徒から提出されたファラデー定数を比較検証し、今後の実験上の注意事項をまとめます(2017/11/18ブログ)講義実験「様々な電気分解」を作成した電源装置で他の電気分解実験にもこの電源を使えます(2017/10/12ブログ)
2019.11.28
コメント(0)
-

文系2単位で化学反応の量的関係;CaCO3とHClaqの反応、生徒実験
文系2単位で化学反応の量的関係;CaCO3とHClaqの反応→2019/11/15ブログで準備してきました「化学反応の量的関係;CaCO3とHClaqの反応」の生徒実験を行いました。今日はその報告です。実験テキストです。ホワイトボードで15分説明、実験操作20分、方付けとまとめ10分でゆとり持って実験できました。ホワイトボード右端はプロジェクターで実験テキストとデータ処理について切り替えながら解説しています。生徒実験CaCO3を測りとっています。ポイントは試薬瓶を薬包紙に近づけることで電子天秤に試薬をこぼさないこと。塩酸(1mol/L)をメスシリンダーで35.0mL測りとる。駒込ピペットの持ち方、使い方を指導しました。実験No.1〜6を準備して、ビーカー、HClaq、CaCO3の全量を測り、記録します。CaCO3を塩酸に投入し、薬包紙で蓋をして攪拌します。3分しっかり反応させると、いい結果が出ます。CO2が逃げて質量が小さくなります。再度、全質量を測ります。実験操作は15-20分でした。方付けとデータ処理の指導反応した溶液は流しに捨させて、水道水で洗い、洗ビン中の純水ですすがせます。グラフ用紙を配布し、グラフの書き方を指導しました。レポートはグラフ用紙に上のように記入して、次回提出です。方付けとまとめに10分使いました。
2019.11.19
コメント(0)
-

文系2単位で化学反応の量的関係;CaCO3とHClaqの反応
今年は文系2単位で「化学基礎」を授業しています。昨年は理系4単位で6月に行った生徒実験をぶっ込みます。文系の生徒たちはかなりよく勉強してくれていますので、理系のテキストそのままです。今日は予備実験を行いました。テキストはテーマは①反応の量論の検証②正しいグラフの書き方 の2点です。特に、文系であろうと今後グラフで表現しなければならない場面がたくさんあるでしょう。そのために、基本的なグラフの書き方を指導したいと思っています。操作は、①はじめに炭酸カルシウム0.5g-3.0gまで6つの質量を測ります。②その間、6つのビーカーに濃度未知(約1mol/L)の塩酸をメスシリンダーで35.0mLは刈り取っておきます。 (ここまで14分)③ビーカーに薬包紙にとった炭酸カルシウムをのせて(反応させず)全量を計り記録します。④炭酸カルシウムをビーカーの塩酸に投入し、薬包紙で蓋をして反応をさせます。⑤操作③④を繰り返して、6つの組み合わせを記録し、反応させます。⑤しばらく(3分ほど待った方が良い)ビーカーをゆすりながら反応させると発泡がなくなります。 (炭酸カルシウムが過剰なNo.4-6は白濁したままです)⑤発泡がなくなったビーカーの質量を(薬包紙の蓋をしたまま)測り、記録します。 (ここまで27分)考察は、②グラフを書いて提出してもらいます。 測定結果・反応式・③の計算はそのグラフの空いているところに記入してもらいます。予備実験で得たデータで書いたグラフです。この実験は毎年とても良い結果を出してくれます。生徒が、頑張ってグラフで表現してくれるか楽しみです。
2019.11.12
コメント(0)
-
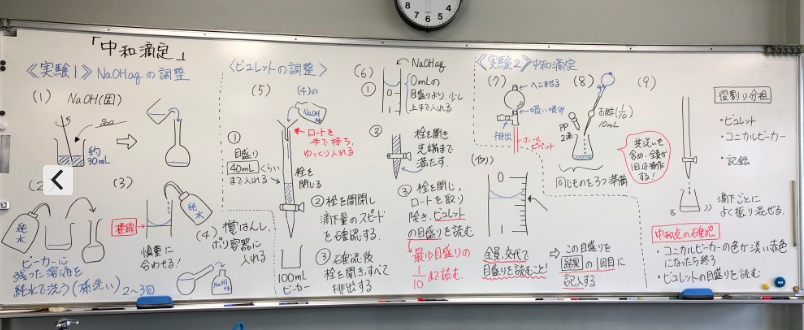
2年理系化学実験「中和滴定」の板書とプリント
現在、文系2単位2クラスを教えています。理系4単位の授業では同僚U先生が「中和滴定」の実験を行なっていましたので、お断りして板書とプリントの写真を撮らせていただきました。今後の参考にさせていただきます。U先生は水酸化ナトリウム水溶液の調整をしています。50分の授業ですが、実際の滴定に取り掛かったのが残り10分くらいでした。ちょっと時間的には厳しい展開です。全員が1つの説明ー実験操作を順に行い、皆そろって同じ操作をしていたのでペースが遅かったようです。また、水酸化ナトリウム水溶液の調整は時間がかかっていたようです。私は、「メスフラスコの使い方」では食酢の希釈を行い、一気に事前説明したあと、巡回しながらフォローします。これで滴定操作は3回から4回でき、あとかたずけまで時間配分をとることができます。こちらの方がよいなあと不遜ながら思いました。生徒実験:中和滴定のレポート→2018/9/21ブログ上は昨年の中和滴定の結果へのリンクです。実際の実験、予備実験へは、上のリンクをたどってください
2019.10.01
コメント(0)
-

高速度撮影960FPSをCyberShot RX100Vで試しました
おなじみのミルククラウンです。シャーレに牛乳1.5mmためて、上方30cmから牛乳を滴下しました。撮影:RX100Ⅴ(SONY CyberShot)、 露出・シャッタスピード自動、HFRモード960FPS編集:iMOVIE、速度1.25倍に拡大牛乳量を変えていくつか試しましたが、この条件が最も良かったです。ほぼ、カメラ本体にお任せでしたが、とてもよく撮れました。最高で1秒間あたり960枚の画像を取り込めます。3秒間の現象をイベントトリガーで撮りました。イベントトリガーは繰り返し3秒間ずつ撮影し、シャッターを押すと直前の3秒間の動画がSDカード(SONYの超高速カード)に転送される仕組みです。このカメラは、「爆発の反応速度」計測に使おうと思い手に入れてもらいました。様々な高速化学反応の解析に利用できると思います。
2019.07.30
コメント(0)
-

自作ペリスタポンプで酸塩基滴定
先日作った、ペリスタポンプで酸塩基滴定をしてみます。滴定用ペリスタポンプを作ってみました→2019/06/26ブログ装置と実験器具は次の写真です。ビュレット先端にポリエチレンチューブをつなぎ、さらにポンプ、滴下用ガラス管へとチューブをつなぎます。①はじめに、0.1mol/LのNaOH水溶液に滴下用ガラス管を入れ、ポンプを逆転させて、NaOH水溶液をビュレットに注入します。←通常ビュレット上からロートを使ってNaOH水溶液を入れるのですが、面倒なので逆転スイッチをつけておきました。意外に楽です。②ビーカーにホールピペットで0.1mol/L塩酸10.00mLをビーカーにとり、スターラーにセットしフェノールフタレインを2滴入れました。③ビュレット目盛りを読んで、スイッチを「吐出」にし、流量つまみを高速にしてプッシュスイッチを押します。←押している間、滴下用ガラス管からNaOH溶液が塩酸の入ったビーカーに注がれます。④ビーカーに入った滴定液の赤→無色の変化が遅くなったところで流量つまみを絞って、流出を遅くします。こうすると、プッシュスイッチを一回カチッと押すと一滴滴下できます。⑤ビーカーの液が淡い赤色になったら滴定終了。目盛りを読んで滴下量を算出します。⑦かたずけ:洗浄はビーカーにためた純水を替えながら、3回ほど吸い上げ・吐出を繰り返して、ビュレット・ポリエチレンチューブ・ポンプ内のシリコンチューブを洗って終わり。2回滴定を行い、滴定結果はNaOH溶液は9.81mLと9.86mLでした。各回の滴定は1分以内でおわりました。コックを操作するより、圧倒的に速いし、正確です。生徒実験に使うつもりはありません。予備実験で私や実習助手さんが使うといいと思っています。化学部や他の生徒の研究用として供与したいと考えています。また、流量コントロールができるので、カラムクロマトグラフィーの滴下用に使えると思います。製作費は2000円を少し切りました。同じようなペリスタポンプが楽天で売っています。最安値は46389円でした。ペリスタルティックポンプ超低速価格:46389円(税込、送料別) (2019/7/2時点)楽天で購入
2019.07.02
コメント(0)
-

生徒実験「分離と精製」蒸留・ペーパークロマトグラフィー・ろ過
昨年に引き続き「分離」の生徒実験を行いました。予備実験:蒸留・ペーパークロマトグラフィー・ろ過→18/4/10ブログ生徒実験:蒸留・ペーパークロマトグラフィー・ろ過→18/4/12ブログ今年は(有)桐山製作所https://www.kiriyama.co.jp/index.htmlの少量減圧蒸留装置を買ってもらいました。肉厚なガラスなのでちょっとした落下事故でも割れません。特に、枝付きフラスコの枝を折ってしまう事故がなくなって安心して生徒に扱ってもらえます。各パーツの接続はシリコンゴムです。なお、アダプターの減圧吸引口は開放して実験します。また、枝付きフラスコがこれまでの300mLから100mLになり蒸留時間が少なくてすみました。教卓にはこれまでの(よく教科書に出てくる)実験装置(左)と桐山製の蒸留装置(右)を並べています。左の蒸留装置は間違いがあり、実験前に間違い探しをしてもらいました。蒸留する液体の量、沸騰石、冷却水を流す方向、温度計の位置、アダプターの先のゴム密閉が間違いです。実験前に実験書を渡し、事前に実験のイメージトレーニングしてもらっていますので、生徒はすぐ見つけます。その後、バーナーの扱い方など実験上の注意をします。ここまで、授業開始から15分。実験操作は15分で終わります。枝付きフラスコの方に赤ワイン(アルコール濃度17%)を20mL入れて加熱します。留出開始の温度や赤ワイン・留分の匂いや感触を記録してもらいます。最後に、留分を蒸発ざらに移してガスマッチで点火、濃度の高いエタノールなので綺麗に燃えます。残りの15分でぺーパークロマトグラフィーによる、水性ペン黒と赤の色素の分離、ろ過によるパウダーシュガーから、デンプンの分離を行います。以上の操作と結果については昨年のリンク(予備実験の方)を上に貼っておきますので、そちらをご覧ください。最後の5分で後片付けをして終了です。実験テキストです。
2019.04.17
コメント(0)
-

「昇華法」化学基礎の回覧用試料作成
昨年、煎茶からカフェインの昇華法による単離を試みました。1学期の授業準備③昇華法…ただいま成長中→18/4/3ブログ昨年はホットプレート200℃で単離しましたが、今年は180℃に下げて試みました。カフェインの昇華点は178℃です。あまり温度を上げ、長時間加熱すると結晶が茶色になってしまいます。写真は、平面の蒸発皿に線茶葉15gほど入れて、180℃で2−3時間加熱。これを3回茶葉を取り替えて漏斗にカフェインを昇華させます。羽毛のような結晶が付いています。残った、茶葉です。実験室内はほうじ茶の匂い。このほうじ茶とロートについたカフェインを授業に持っていき、回覧しました。
2019.04.11
コメント(0)
-
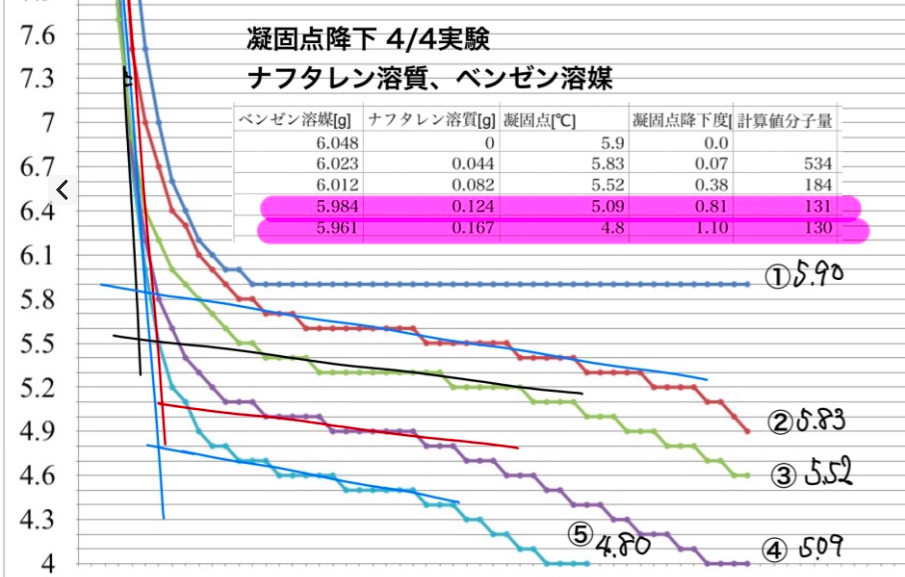
「凝固点降下」予備実験⑦まとめ
「凝固点降下」予備実験の準備(RC-4HCを使って)→19/3/4ブログで安価な(当時999円)温度湿度データロガーRC-4HCを手に入れたので、面倒な温度変化の記録が必要なくなりました。そこで、生徒実験「凝固点降下による分子量測定」を再検討しようと思い立ちました。「凝固点降下」予備実験①水の凝固点(RC-4HCを使って)→19/3/5ブログ「凝固点降下」予備実験②:容器の検討→19/3/27ブログはじめに、容器の検討から。これまでの生徒実験では、試験管に溶媒・溶液を入れてデジタル温度計(感度0.1℃)で15秒おきに温度を記録していました。溶媒・溶液量を減らしたり、温度変化を迅速に行うために内径5mmのガラス管に液を入れて試しました。結果を検討した結果、❶温度センサーがガラス管内壁に触れて、冷却されすぎて凝固点が下がり続けるため容器内径は大きくとって内壁ガラスに触れないようにする。これは、試験管を使っても起こりうるので実験時にはガラスにセンサー先端が触れないようにする。「凝固点降下」予備実験③:ナフタレン-シクロヘキサン溶液→19/4/2ブログ生徒実験で毎年行っている実験です。容器を考慮しつつ、再度検討して見ます。シクロヘキサン1級品を溶媒として使いましたが、溶媒だけの温度変化を測定した結果、徐々に凝固点が下がって一定値を取りません。シクロヘキサンは生徒実験に供する薬品では純度99%以上、凝固点6.0-7.0℃(薬品会社のデータ、文献値6.5℃)と変動します。❷シクロヘキサンは純粋ではないかもしれない。溶媒の凝固点は一定しない。しかし、モル凝固点降下20.2[K・kg/mol]と大きい、さらに他の有機溶媒に比べて毒性が低いので、生徒実験では利用していく。「凝固点降下」予備実験⑥:ナフタレン-シクロヘキサン溶液・濃度の影響 →19/4/9ブログ「希薄溶液の凝固点降下」というが、どのくらいの濃度まで凝固点降下によって溶質の分子量が誤差少なく得られるかを検討しました。❸これによると、0.08〜0,2[mol/kg]までは理論値128に近い値を出しています。この濃度以上になると分子量が大きい方にずれていきます。シクロヘキサン以外の溶媒についても検討しました。「凝固点降下」予備実験④:ブドウ糖-水溶液→19/4/4ブログ水溶液で凝固点降下を検討しました。ブドウ糖(分子量180)の水溶液0.20[mol/kg]で行なった結果、分子量測定値は168でした。(塩化ナトリウム水溶液でも行いました)しかし、時々凝固しないまま冷却材の温度まで下がってしまいました。過冷却現象がひどく起こります。時々、撹拌しないと凝固しにくいです。❹水を溶媒にするときに2つ困難がある。1つは凝固しにくい。2つ目はモル凝固点降下1.85[K・kg/mol]と低すぎるので、凝固点降下度が小さくなる。溶媒としての水は魅力的ですが、以上の理由で生徒実験には向きません。「凝固点降下」予備実験⑤:ナフタレン-ベンゼン溶液→19/4/4ブログベンゼン溶液でも検討しました。❺ベンゼン1級品でも凝固点は一定しています。ナフタレン溶液では0.1mol/kg〜0.28mol/kgまで誤差少なく分子量が得られる。この点ではシクロヘキサンよりも安心して使えますが、次の理由から生徒実験には使えません。(1)シクロヘキサンより毒性が強い。(2)モル凝固点降下5.12[K/kg/mol]とシクロヘキサンより低いので、凝固点降下度が低い。それぞれの結論は青字で示しました。その根拠となる実験操作・結果については赤字のリンクをクリックしてください。
2019.04.10
コメント(0)
-
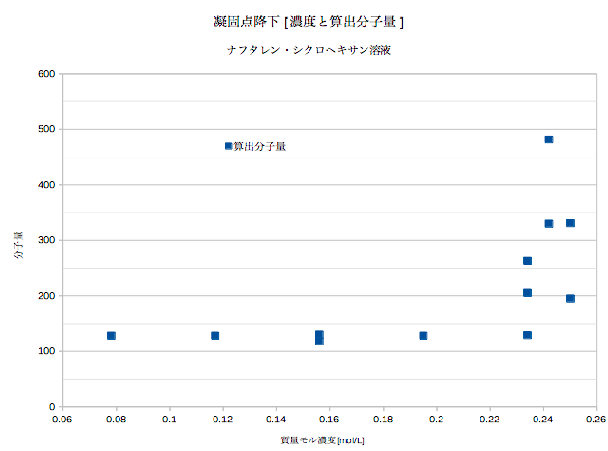
「凝固点降下」予備実験⑥:ナフタレン-シクロヘキサン溶液・濃度の影響
生徒が、ナフタレン-シクロヘキサン溶液凝固点降下を各濃度で検証してくれました。結果は以下です。縦軸に測定計算されたナフタレンの分子量(理論値128)、横軸に質量モル濃度[mol/Kg]をとってあります。これによると、0.08〜0.2[mol/Kg]までは理論値128に近い値を出しています。実験は、デジタル温度計、冷却材は氷水に感剤NaClをサジ1杯分加えてあります。15秒ごとに測定。このデータでグラフを描き凝固点を得ました。生徒実験はナフタレン約0.1〜0.15g、シクロヘキサンは約7g(0.15mol/Kg前後)で行ってます。
2019.04.09
コメント(0)
-
「凝固点降下」予備実験⑤:ナフタレン-ベンゼン溶液
これまで、「凝固点降下」生徒実験の検討を行ってきました。安価な温度湿度データロガーRC-4HCを使って、溶質溶媒の組み合わせ・濃度・容器について検討しています。今回はベンゼン溶媒ーナフタレン溶質で溶質と溶媒の組み合わせと濃度を検討します。ベンゼンは発がん性ですから、あまり生徒実験では使われません。共役系のナフタレンとの相性が良さそう(=シクロヘキサンより溶質分子のクラスターができないのではと考えたので)各種の濃度で実験しました。約6gのベンゼンに対して0.124g〜0.343gの範囲で、計算した分子量が誤差の少ない値を出しています。結論としては、毒性を考えると生徒実験には積極的に使えないのですが、ベンゼンはシクロヘキサンより凝固点が一定(データロガーRC-4HCでは5.9℃で一定、文献値5.5℃)しているので純度の高いものが得やすいので魅力的です。→「凝固点降下」予備実験③:ナフタレン-シクロヘキサン溶液19/4/2ブログ
2019.04.08
コメント(0)
-
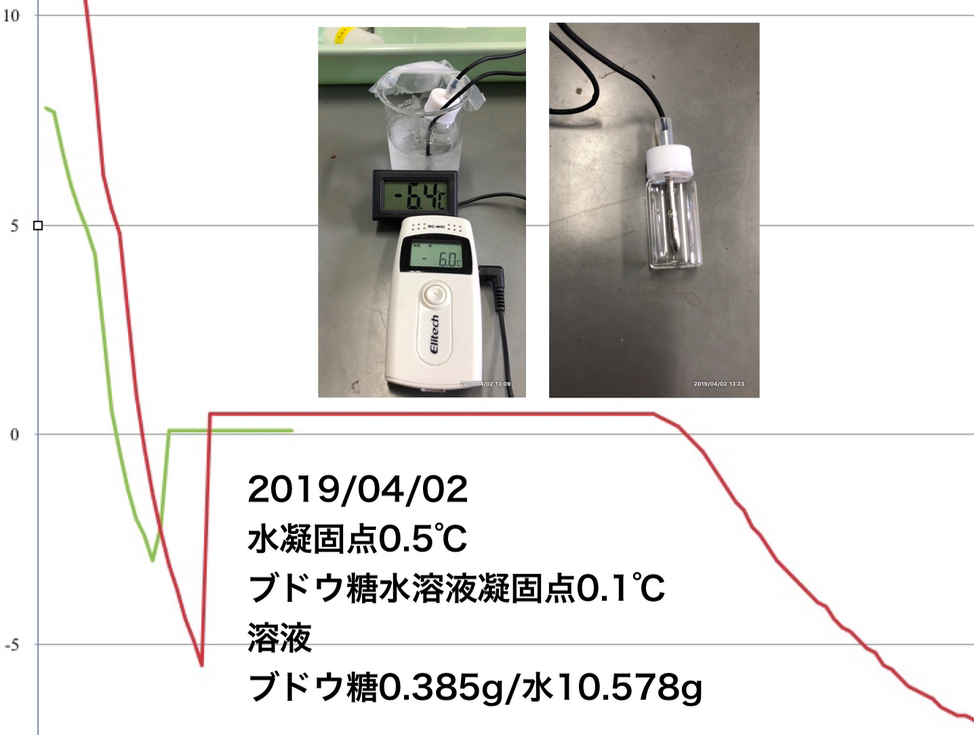
「凝固点降下」予備実験④:ブドウ糖-水溶液
「凝固点降下」予備実験③:ナフタレン-シクロヘキサン溶液→19/4/2ブログに続いて、水溶液でも試してみました。水溶液の凝固点降下も調べてみました。凝固点降下度ΔTは0.4℃でした。水のモル凝固点降下は1.85と小さく、有効数字の問題もあり、実用になりませんが、分子量を計算してみます。ΔT=Kf・m0.4=1.85x(0.385/M)/0.010578分子量M=168でした。ブドウ糖の分子量は180。水溶液は電解質の凝固点降下など魅力的な素材なのですが、濃くしすぎると凝固しにくくなり、いつまでたっても固体にならない問題を経験しています。今回テストした濃度(0.20mol/Kg)なら凝固するのですが、凝固点降下度大きくするためにさらに高濃度にしたところ、凝固しませんでした。水溶液は「凝固点降下」の生徒実験には向いてないのかなぁと思っています。
2019.04.04
コメント(0)
-
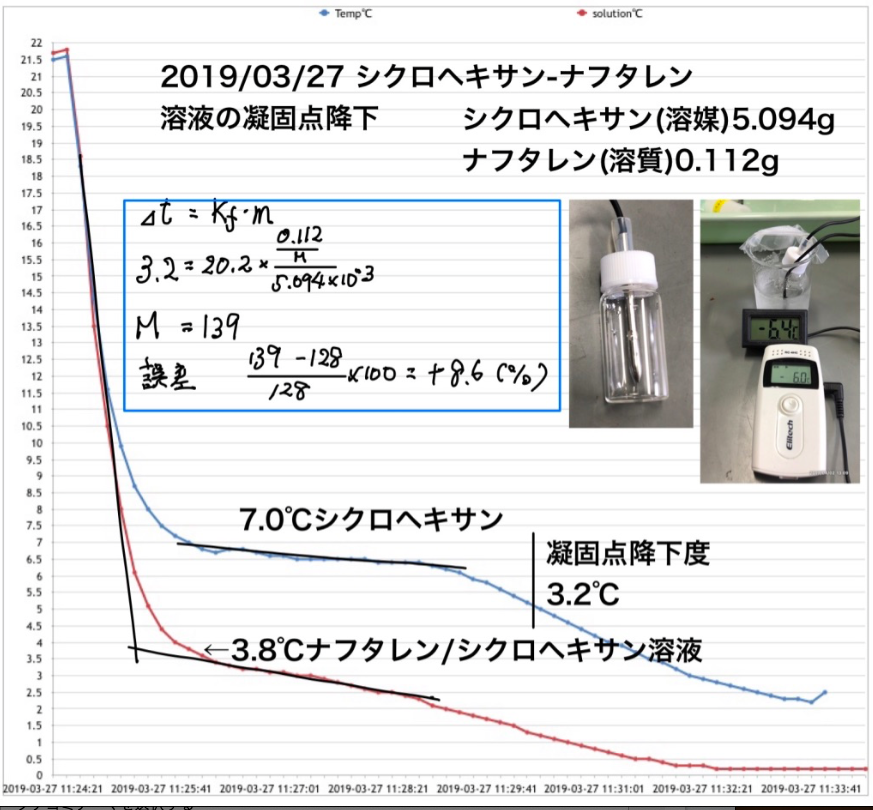
「凝固点降下」予備実験③:ナフタレン-シクロヘキサン溶液
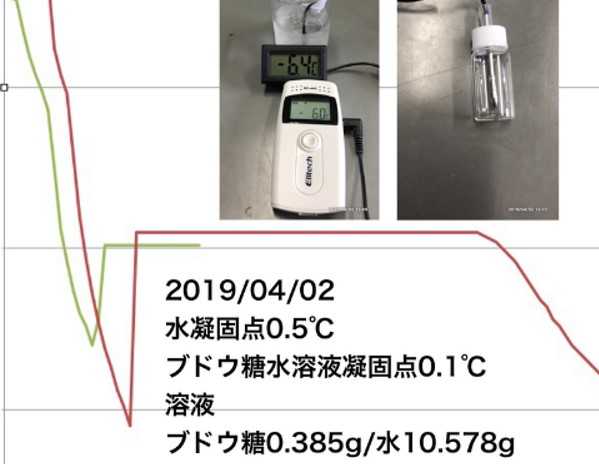
「凝固点降下」予備実験①水の凝固点(RC-4HCを使って)→2019/3/5ブログ「凝固点降下」予備実験②:容器の検討→2019/3/27ブログこれまで、「凝固点降下」の実験準備をしてきました。この方法で実際にナフタレン-シクロヘキサン溶液の凝固点を測ってみました。その結果、誤差が大きくなってしまいましたが、報告します。生徒実験より高い濃度で行いました。凝固点降下から得られるナフタレンの分子量は139。誤差は+8.6%でした。これまでの検討から、濃度が大きいと誤差が+に大きくなることがわかっています。なお、冷却材は20%エチレングリコール水溶液30−40mLを冷凍庫にいれておきます。シャーベット状になるのでこの中に容器を入れて冷却します。水温は−10℃前後になります。今後、最適な濃度を検討し、生徒実験として組み上げたいと思っています。
2019.04.02
コメント(0)
-
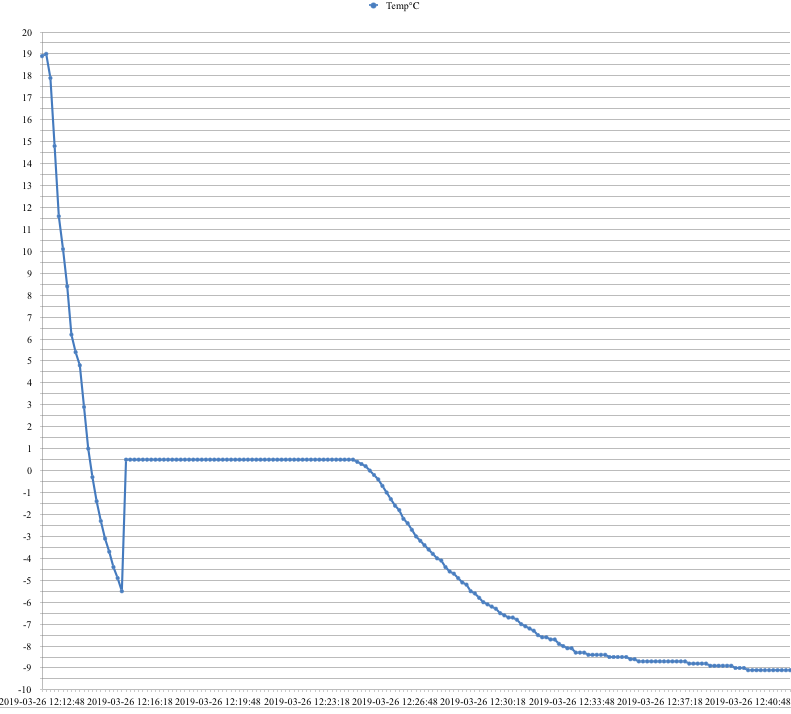
「凝固点降下」予備実験②:容器の検討
「凝固点降下」予備実験①水の凝固点(RC-4HCを使って)→2019/03/05ブログではガラス管を封じたもので純水の凝固点を測定しましたが、凝固点付近で徐々に温度が下がり、一定になりません。デジタル温度計プローブとガラス管が触れ合ってしまうのが原因だと思います。そこで、直径24mmのフタ付きサンプル管に純水を入れ、デジタル温度ロガーRC-4HCで測定しました。サンプル管はガラス管に比べて太いので、ガラス面とプローブが接触しません。冷却材は、50mLのビーカーにエチレングリコール水溶液を入れて冷凍庫で冷やし、シャーベット状にしたものを使います。データロガーは10秒ごとに温度測定するよう設定しています。蓄積されたデータをRH-4HCから取り込んで、表計算ソフト(Apple純正Numbers)でグラフ化しました。もちろんエクセル形式*.XLSX で出力できます。結果は、以下のグラフて凝固点測定値は0.5℃でした。補正しないまま測りましたので、0℃にはなりません。2回行いましたが、2回とも同じ結果です。ただし、静置しておくと過冷却状態のまま冷却材温度まで下がりつつけていきます。-3から-4℃、振ってやると氷が出始めて水の凝固点まで上昇し、一定になりました。これで生徒実験を組めそうかなと思っています。まだまだ、精度を上げるために工夫が必要ですが、これを使って、昨年生徒実験を行なったナフタレンのシクロヘキサン溶液の実験をやり直してみます。具体的な方法と、結果については次回に。
2019.03.27
コメント(0)
全141件 (141件中 1-50件目)











