全893件 (893件中 1-50件目)
-
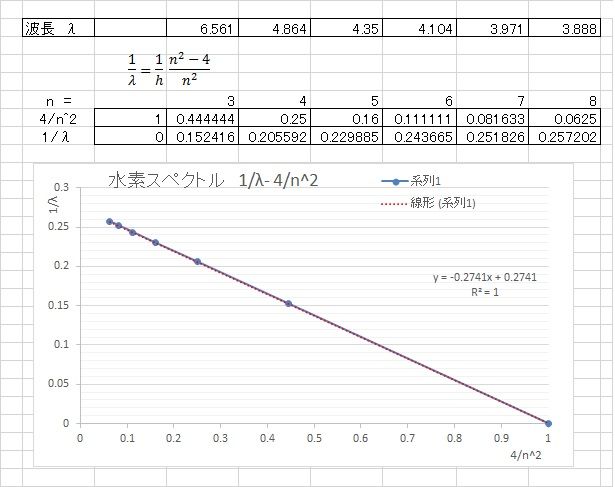
輝線スペクトル バルマー系列式
水素のスペクトル波長の不思議な規則性に取りつかれた科学者の一人バルマーが出した結論が報告されたのは、1884年だった。この時、バルマー Johan Jakob Balmerは59歳。彼は、最初スイス、バーゼルの自然科学協会の会誌(1884年6月号)に、この報告「水素のスペクトルに関するノート」を投稿した。そして、この報文は、Annalen der Physik (1885年1月) p80 – p87)に転載されたのである。この年は、ニールス・ボーアの生まれた年でもある。この報文が、後に量子力学の躍進のきっかけを作ったということを、まだバルマー本人も全く知る由もなかった。ブンゼンとキルヒホフによって始められた分光分析は、実績として数多くの元素発見につながっているが、量子力学の扉も開いたのである。バルマーの公式とも言われている式は、下記の式である。波長 λ = A m^2/(m^2-n^2 ) = A m^2/(m^2 – 4) A=364.56 nm (n =2 m = 3, 4, 5, 6 )この式で、この結論に至る過程が不明なのは、● m^2/(m^2-n^2 )・・・・・(1)● A=364.56 nm・・・・・(2)この二箇所バルマーの公開した報文に、この結論に至る思考過程が記載されていないのである。バルマーの報文の英訳は、下記で閲覧できる。(原文はAnnalen der Physik (1885年1月) p80 – p87)http://web.lemoyne.edu/~giunta/balmer.htmlバルマーは、オングストロームの発表しているスペクトルの値からHα (C-line) = 9/5 h = 6562.08、 6562.10Hβ (F-line) = 4/3 h = 4860.8、 4860.74Hγ (near G) = 25/21 h = 4340、 4340.1Hδ (h-line) = 9/8 h = 4101.3、 4101.2いきなり h表示でこの4本のスペクトルの関係性を表示している。h表示で表記している定数は、 3645.6 と数値を記している。まず、(1) m^2/(m^2-2^2 ) について、数学者バルマーが、考えたであろう考え方は、素因数分解法であろうというのが、もっとも合理的ではないだろうか。4本の輝線の波長を下記整数とすればHα = 6561Hβ = 4864Hγ = 4350Hδ = 4104素数分解するとHα = 6561 = 3^2 x 729Hβ = 4864 = 4^2 x 304Hγ = 4350 = 5^2 x 174Hδ = 4104 = 6^2 x 114と導かれる。そして6561 x (5/3^2) = 4864 x (12/4^2) = 4350 x (21/5^2) = 4104 x (32/6^2)の関係が成り立つ。よって波長 λ = A m^2/(m^2-2^2 ) の式 の m^2/(m^2 - 2^2) を導き出したと言える。(2)については、かなり試行錯誤したがバルマーの式は、𝜆=ℎ m^2/(m^2−4)この逆数を採ると、 1/λ=(1/h) (m^2-4)/m^2 1/λ=(1/h) (1-4/m^2)そして、簡略化した 1/λ=1-4/m^2 のグラフ化を考える。グラフの式化したものは、 y = - 0.2741x + 0.2741グラフの Y軸の切片 0.2741 から逆数をとると、3.6483 が算出できる。エクセルでは、intercept関数からも 0.2741 が算出できる。従って、h=364.83 nm となる。オングストロームがだした波長Hα = 6562.1Hβ = 4860.74Hγ = 4340.1Hδ = 4101.2を挿入すると、近似式は、 y = - 0.2743x + 0.2743 となりグラフの Y軸の切片 0.2743 から逆数をとると、値は、3.6456で波長は、364.56 となり、これは、バルマーが出した値と同じである。数学者バルマーにとって、逆数を採って、グラフ化することは、容易に思いつくことであろう。数学者バルマーが、どの方法でこの公式にたどり着いたか、今は知る由もない。さらに、バルマーは、報文の後の方で、現在パッシェン系列(n=3)、ブラケット系列(n=4)、プント系列(n=5)として知られている系列の存在の予言を行い、パッション系列は1908年に発見され、ブラケット系列は1922年に発見され、プント系列は1924年に発見された。メンデレーエフも、周期表の報文で大胆な予言を行っているが、バルマーも、メンデレーエフに劣らない大胆な予言を行っているのだ。参考文献大野公一先生 「バルマーの謎」 http://211.15.34.33/ohnok/Balmer.HTMローゼンフェルト 著 江沢洋 訳・著 「ボーア革命」 日本評論社マンジット・クマール 著 青木薫 訳 「量子革命」 新潮文庫先日(2/4)、本屋の文庫本コーナーで、ふと目を落としたら、「量子革命」という文字が飛び込んできた。アインシュタインとボーアを軸に話が展開している。2017.2.1発行この二か月間、量子力学に翻弄されている。この年になって足を踏み入れようとしているが、なかなか入れさしてもらえない。脳が拒絶している。
2017年01月26日
コメント(0)
-
アーチボルド・クーパー
On a New Chemical TheoryThe end of chemistry is its theory. The guide in chemical research is a theory. It is therefore of the greatest importance to ascertain whether the theories at present adopted by chemists are adequate to the explanation of chemical phenomena, or are, at least, based upon the true principles which ought to regulate scientific research.Phil. Mag. 16, 104-116 (1858)これは、アーチボルド・クーパー氏が1858年に発表した「On a New Chemical Theory」の書き出しである。化学の終着点はその理論である。化学研究における指針も理論である。従って、化学者が現在適用している理論が化学現象を説明するに値するかどうか、あるいは少なくとも、科学研究を律すべき真の原則に立脚しているかどうかを確かめることは、極めて重要である。と始まるこの力強く革新と自信に満ちた書き出しから展開された化学構造論は、異彩を放っていた。クーパー氏が、化学構造を現すために表記した表記法が、現在我々が使っている化学構造を現すための基礎となっているものであるる。当時の表記法としては、革新的なものであった。だが、クーパー氏自身は、この論文が、ケクレの同年1858年に発表した「化合物の構造と変化について、ならびに炭素の化学的性質について」の論文の出現により失意に変わっていった。「クーパーの理論は、その著者とともに忽然とあらわれ、僅かな目撃者の眼を射抜くような鋭い閃光を放ったかと思うと、彗星のように天界はるかに飛翔し去ったのである。」と、柏木肇教授は、「有機化学構造論の解説」で語っている。
2016年06月09日
コメント(0)
-
化学史の見方
今まで断片的に書いてきたテーマを、系統的に人物で纏めてみた。真空史 トリチェリー メルセンヌ パスカル ゲーリケ フック ボイル立体化学史 パスツール ウィスリツェニス ファントホッフ ルベル フィシャー周期表史 デーベライナー ペッテンコッファー ニューランズ シャンクルトワ マイヤー メンデレーエフ レイリー ラムゼー モーズリー化学結合史 フランクランド ルイス ラングミュア ポーリング電気化学 ガルバーニ ボルタ デービー ファラデー分子構造史 ベルセリウス ローラン コルベ フランクランド クーパー ケクレ 今後の展開は、どうしようか。
2016年06月01日
コメント(0)
-
酒石酸工学異性体に至るパスツールの動機
パスツールの1860年講演「天然有機物の分子デスシンメトリーに関する研究」の中に ”酒石酸の光学異性体発見”の実験をするに至る動機を語っている部分が第一講の4に述べられている。IV.I must first place before you a very remarkable note by Mitscherlich which was communicated to the Académie des Sciences by Biot. It was as follows:-- "The double paratartrate and the double tartrate of soda and ammonia have the same chemical composition, the same crystalline form with the same angles, the same specific weight, the same double refraction, and consequently the same inclination in their optical axes. When dissolved in water their refraction is the same. But the dissolved tartrate deviates the plane of polarisation, while the paratartrate is indifferent, as has been found by M. Biot for the whole series of those two kinds of salts. Yet," adds Mitscherlich, "here the nature and number of the atoms, their arrangement and distances, are the same in the two substances compared."ミッチェルリッヒは、付け加えて、「原子の種類と数、配列と距離、比較しているこの二つの物質でまったく同じである。」この報告がパスツールを引きつけて、解明への衝動に駆られて行った。But no isomeric bodies existed whose relations in respect to molecular arrangement could be known. This desideratum was supplied for the first time by the discovery of the constitution of paratartaric acid, and of the constitutional relations of the right and left tartaric acids. We know, on the one hand, that the molecular structures of the two tartaric acids are asymmetric, and on the other, that they are rigorously the same, with the sole difference of showing asymmetry in the opposite senses. Are the atoms of the right acid grouped on the spirals of a dextrogyrate helix, or placed at the summits of an irregular tetrahedron, or disposed according to some particular asymmetric grouping or other? We cannot answer these questions. But it cannot be a subject of doubt that there exists an arrangement of the atoms in an asymmetric order, having a non-superposable image. It is not less certain that the atoms of the left acid realise precisely the asymmetric grouping which is the inverse of this. Lastly, we know that paratartaric acid results from the juxtaposition of these two inversely asymmetric atomic groupings. パスツールは、「酒石酸の原子が、不規則な四面体でラセンのスパイラルを形成している。」と述べている。もう一歩すすめば、立体配置が、描き得たであろうが、パスツールの関心事は、既に有機化学には無く、微生物に移っていた。
2016年05月16日
コメント(0)
-
乳酸の異性体
ヨハネス・ウィスリツェヌス(Johannes Wislicenus、1835年 - 1902年)は、ドイツの化学者。日本での知名度は、高いとは言えない化学者である。乳酸の異性体に関する研究は1873年に報告されたものである。1887年には、マレイン酸とフマル酸の関係についての論文を報告している。ファントホッフの「空間的に見た分子の構造」が報告されたのは、1874年ファントホッフが、学生たちに語った言葉として残っているのは、「ユトレヒト大学の図書館で、ウィスリツェヌスの乳酸の異性体に関する論文を見つけて読んで、不整炭素のアイデアを思いついた。」若きファントホッフに、このウィスリツェヌスの乳酸の異性体の論文が、立体化学の扉のキーを与えたのは間違いない。1873年に、ウィスリツェヌスの発表した「乳酸の異性体について」の中で「分子の化学的性質は、これを構成する諸原子の種類と、それらの相互の結合の序列、すなわち分子の化学構造によって規定されることは、現在一般に認められている確信である。本来このことに劣らず正しいと思われるのは次の仮定である。すなわち,化学構造上は同ーの分子が,幾何学的配置の相違によってこれはまず分子の大きさおよび、形の変化を起すことができるし,それは何れにもまして,物理的性質の変化を顕著ならしめる一一物理的挙動と化学的挙動との境界にある諸性質,たとえば溶解度,結晶形,結晶水結合等々にも,なんらかの差異を起すことができる。」ファントホッフの「空間的に見た分子の構造」は、まずオランダ語で出版され、反響がほとんどなく、ついでフランス語で出版された。これを知るところとなったウィスリツェヌスは、ファントホッフに連絡し、ドイツ語での出版を薦めた。この詳細は、梶博士によって報告されている。このファント・ホフのフランス語版小冊子に最初に好意的に反応したのが,立体化学研究の先駆的研究者ヴィスリツェヌス( Johannes Wislicenus, 1835-1902)だった。 1875年 11月に彼は,ファント・ホフに手紙を書き,本を賞賛してそのドイツ語訳を提案した。翻訳は,当時,ヴィスリツェヌスの助手だったヘルマン(Felix Hermann)が担当した。ヘルマンは単に翻訳するだけでなく,いくつかの重要な改訂を提案した。そのためにフランス語版とはかなりの異同が生じた。まず,本のタイトルがより明確に内容を表す『空間における原子の配置( Die Lagerung der Atome im Raume)』となった。さらに 4ページにわたるヴィスリツェヌスの序文が付けられ,本文全体に文献注が付けられた。フランス語版では,巻末にまとめて付けられていた図が,本文中の然るべき位置に入れられた。まだ構造もはっきりしておらず(すでに述べたようにケクレ説とラーデンブルク説のいずれとも決着がついていなかった),異性体について十分なデータのなかった芳香族についての章は省略された。さらに巻末付録には,厚紙で分子模型を作るための説明が図とともに付けられた。このドイツ語版が出版された。「化学と工業」参考化学の原典11 有機立体化学 化学史伝
2016年05月11日
コメント(0)
-
比熱比と単原子気体
新元素アルゴン気体が、単原子だと決め手になったのは、この比熱比であった。比熱比比熱比γ・・・ 定積モル比熱Cpと定圧モル比熱Cvの比を比熱比γという。 気体のモル比熱 J/molK 分子種 気体種 Cp Cv Cp/Cv単原子分子 He 20.94 12.62 1.66 単原子分子 Ne 20.76 12.47 1.66 単原子分子 Ar 20.89 12.51 1.67 二原子分子 H2 28.85 20.53 1.41 二原子分子 O2 29.44 21.09 1.40 二原子分子 N2 29.17 20.82 1.40 「アルゴン、大気中の新しい成分(Argon, a New Constituent of the Atmosphere) 」(F-04) の論文において、新元素アルゴンの比熱比1.66 から、単原子気体と特定した。アルゴンの発見された1895年には、単原子気体は、高温における水銀蒸気気体のみであった。単原子分子の定積比熱Cv は、一つの原子のみから構成されるために、運動の自由度は並進運動のみでから、f = 3 である。従って Cv = (f / 2)R = (3/2)R となる。マイヤーの関係式によると、定積比熱Cv と定圧比熱Cp の間には以下の関係が成立する。 Cp = Cv + R マイヤーの関係式にCv= (3/2)R を代入すると Cp = (3/2)R + R = ( 5/2 )R となる従って比熱比 γ= Cp / Cv = 5/3 =1.67 二原子分子の場合、自由度f = 5 多原子分子の場合、自由度f = 6 となるので、比熱比はそれぞれ、単原子分子 γ≒1.67、二原子分子 γ≒1.4、多原子分子 γ≒1.33 となる。従って、酸素などの二原子分子気体は、比熱比1.40の値を示す。この水銀蒸気の比熱比が単原子気体として比熱比=1.67であることは、1876年クントよって明かにされたものである。ネットでの探索で、クントによるこの発見を確認しようといろいろ検索をし、やっとhttps://en.wikipedia.org/wiki/August_Kundtに見出すことができた。 In 1876 at Strasbourg in collaboration with Emil Warburg, Kundt proved that mercury vapour is a monatomic gas.アウグスト・クント(1839 - 1894) ドイツの物理学者。音が振動波であることを可視化できるクントチューブは、現在でも実験室で現役である。
2016年02月29日
コメント(0)
-
113元素
1904年から二年半、ロンドンのラムゼー氏の元に留学した日本人が、小川正孝氏である。そうして新元素ニッポニウムの存在を世に問うたのが1908年であった。しかしながら、小川は、原子量を約100と計算し、周期表では42-モリブデンと44-ルテニウムの間に入る元素としたのだ。当時の日本には、X線分光器は、存在しなかった。1925年ドイツ人ノダックにより自然界においての最後の75番元素レニウムが発見された。実は、この原子量186.2のレニウムこそが、小川の発見した元素だったのだ。惜しくも、周期表に名を刻むことはできなかった。日本人は、世界でまだ認知されていなかった。この幻のニッポニウムから約100年、2015年大晦日に、合成された113番元素が、やっと認定された。 新たな元素の認定は4年ぶりで、113番元素のほかに115番元素と117番元素、118番元素の3つも同時に認められた。これまで欧米とロシアに限られていた元素の発見の歴史に、日本が初めて、やっと周期表に名を刻むことができる。。1908年に小川正孝氏が提出した2論文 Preliminary Note on a New Element in Thorianite Preliminary Note on a New Element allied to Molybdenumwebでの閲覧可能である。
2016年01月02日
コメント(0)
-
未知元素との遭遇 (1)
18世紀の終盤、大英帝国での出来事である。物理学者レイリー卿(1842~1919)は、11mg の数字の謎が、どうしても納得がいかず、この重量差にこだわっていた。元素の周期性がやっと認知されだした1890年代の時代に、彼のこの拘りが、数年後に化学の世界に激震を与えようとは、この時点では、誰もまだ想像すらしていない。その重量差とは、大気窒素と化学窒素、すなわち、大気から得られた窒素と化学的に単離された窒素の重量差(密度差)である。 物理学者であるレイリー卿は、若くして、「青い空の謎」を「レイリー散乱理論」で解き明かした大英帝国の逸材である。彼が、大気の成分の解析に深い興味を抱いていたのは、当然だったのかも知れない。寺田寅彦が語るレイリー卿は、「興味の向くままむつかしい数学的理論もやれば、甲虫の色を調べたり、コーヒー茶碗をガラス板の上にすべらしたりした。彼にはいわゆる専門はなかった。しかし何でも、手を着ければ端的に問題の要点に肉迫した。」の通り物理の世界から化学の世界までの幅広さを紹介している。・・・「レーリー卿」寺田寅彦作 大気の主要気体の密度の精密測定に取りかかり、窒素の測定に至って、通常は大気から酸素や二酸化炭素などを除去し窒素試料を作成するが、レイリー卿は、さらに付け加えて、アンモニア分解からの窒素試料の密度も測定し、異なる過程から得た生成窒素の重量差(密度差)の謎に辿り着いたのである。これが、レイリー・アプローチとでもいう全く天才的な着眼点から得た結果だった。この重量差の疑問を世に問うたのが、1892年Natureの誌上に掲載された「窒素の密度」(F-01) と題された論文である。1893年に「主ガスの密度について(On the Density of the principal gases)」(F-02) を発表、続いて1894年4月には、「窒素の密度の測定において遭遇した異常について(On an Anomaly encountered in Determination of the Density of Nitrogen Gas) 」(F-03) を発表している。 この重量差とは、レイリー卿の1894年の報文(F-03) に沿って、説明すると、まずは化学窒素1. NOからの窒素 2.30008 g2. N2Oからの窒素 2.29904 g3. 亜硝酸アンモニウムからの窒素 2.29869 g 化学窒素の平均 2.2993 g 次に大気窒素1. 赤熱鉄からの窒素 2.31003 g2. 第1鉄塩からの窒素 2.31020 g3. 赤熱銅からの窒素 2.31026 g 大気窒素の平均 2.3102 gこの差は 2.310 – 2.299 = 0.011 g ******* 11 mg レイリー卿はこの論文の最後に付け加えてこう語っている。The nitrogen, obtained altogether in four ways from chemical compounds,is material lighter than the above, the difference amounting to about 11mg., or about 1/200 part of the whole.1892年9月のNatureに投稿されたこの「重量差の疑問」の問いかけに同年11月応じたのがロンドン大学教授の化学者W.ラムゼー氏(1852~1916)であった。また、レイリー卿は、友人で王立研究所教授のデュアー氏(1842~1923)に窒素問題について相談しており、デュアー氏からは「キャベンディシュが関連した実験をやっていたはずなので、原論文の調査をしてみたら」という提言があった。レイリー卿はこの提言に従って100年以上も前の古い論文を調査し、キャベンデッシュ氏(1731~1810)の驚くべき論文を見つけ出したのである。レイリー卿は、1895年の論文でもキャベンデッシュ氏の論文を引用している。また、息子にも次の様に語っている。 キャベンデッシュがこの問題の重要性を私と同じようにハッキリと認識していたことを知って、大変驚いた。しかも、キャベンデッシュは疑問を抱くだけでなく、それを実験で調べていたのである。キャベンデッシュの得た「フロジストン化空気=窒素」からの残留気体(今で言うアルゴンか)が、空気の体積の約1/120であることを、この論文で示していたのである。この1/120の数字の謎にレイリー卿が、さらにこだわったのは、紛れ無き事実である。 1894年8月上旬、レイリー卿とラムゼー氏は窒素とは密度の違う気体を単離し、この気体を「アルゴン」と名付けた。そして、8月中旬、連名でイギリス科学振興協会の年会に、この発見を発表したしたのである。身近で、何の変哲もない大気という気体に、密かに潜んでいた気体は、反応性を示さない元素だったのであるから、直ちには信じられないのも尤もである。当然ながら、疑念を抱く研究者もいたであろう。その疑念を抱く研究者の中には、かのメンデレーエフもいたのである。メンデレーエフは、この正体不明の気体を新元素でなく、当初、窒素の3原子分子と考えていたようである。要するに周期表には、まだアルゴンを受け入れる余地も位置も考えてなかったのである。というよりも、考えたくなかったと言った方がいいのかもしれない。メンデレーエフの見解は、「アルゴン分子が3原子を含むと考えれば、その原子量は14であろう。その場合、アルゴンは凝縮した窒素、N3 と考えられる。この最後の仮説に有利なことはたくさんある。」しかし、この位置を早急に決める必要性もあった。この19世紀の最後の10年間の新元素の発見は、周期系の分野にも、大激震だったのである。 現代の周期表でアルゴンとカリウムを見てみると、当時の研究者達がいろんな疑念を抱いたのも納得である。原子番号=18 Ar (原子量=39.95) これに続くのは原子番号=19 K(原子量=39.10) 1895年1月末に王立協会で、レーリー卿とラムゼー氏が共同で発表した論文は「アルゴン、大気中の新しい成分(Argon, a New Constituent of the Atmosphere) 」(F-04) である。
2015年12月10日
コメント(0)
-
11mg
11mg の差The nitrogen, obtained altogether in four ways from chemical compounds,is material lighter than the above, the difference amounting to about 11mg., or about 1/200 part of the whole. この報文は、1894年に発表された "On an Anomaly encountered in Diterminations of the Density of Nitrogen Gas" の中の一部分世紀末に、激震の議論の始まりだった。大気からの窒素・・・・ 2.3100 g化学物質からの窒素・・ 2.2990 gこの重量差・・・・・・ 0.011 g・・・・11mgこれが、周期表に一列の元素集団を付け加えることになる発端となろうとは、誰も予想しなかった。そして、1895年に、レイリー卿とラムゼーは、「Argon, a New Constituent of Atmosphere 」を発表する。John William Strutt, 3rd Baron Rayleigh の論文集より窒素ガスの謎に迫った論文の軌跡を1892年から1895年の間に発表した論文リスト 197. Density of Nitrogen [Nature, XLVI. pp. 512, 513, 1892.] 201. On the Densities of the Principal Gases [Proceedings of the Royal Society, LIII. pp. 134149, 1893.] 210. On an Anomaly encountered in Determinations of the Density of Nitrogen Gas [Proceedings of the Royal Society, LV. pp. 340344, April, 1894.] 214. Argon, a New Constituent of the Atmosphere. By LORD RAYLEIGH, Sec. R.S., and PROFESSOR WILLIAM RAMSAY, F.R.S. [Phil. Trans. 186 A, pp. 187241, 1895.] 215. Argon [Royal Institution Proceedings, xiv. pp. 524 538, April 1895.] そして、共同研究者であるラムゼーが、カナダのトロントで1897年におこなった講演 「An Undiscovered Gas」の中で予言したさらなる希ガス元素の存在。すなわち、原子量 4のヘリウムと、原子量 39.88 アルゴンが発見されて、未知なる希ガスの存在についてである。原子量約20 原子量約82 原子量約130の三つの希ガス元素の予言である。 There should, therefore, be an undiscovered element between helium and argon, with an atomic weight 16 units higher than that of helium, and 20 units lower than that of argon, namely 20. And if this unknown element, like helium and argon, should prove to consist of monatomic molecules, then its density should be half its atomic weight, 10. And pushing the analogy still further, it is to be expected that this element should be as indifferent to union with other elements as the two allied elements.ヘリウムとアルゴンとの間に、ヘリウムの原子量より16ユニット大きい、アルゴンより20ユニット小さい、ひとつの未発見元素があるにちがいない。そして、もしこの未発見元素が、ヘリウムとアルゴンと同じく単原子分子よりなることが、判明すれば、その密度は原子量の半分で10であろう。さらに、類推をすすめれば、二つの同類の元素のように、他の元素に対して無反応・無関係な元素だと予想される。この講演から約10カ月後に新希ガスを発見している。価電子元素表
2015年11月12日
コメント(0)
-

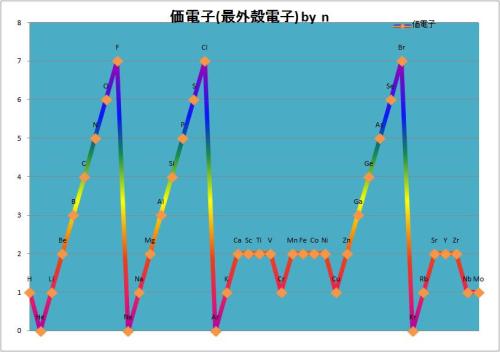
価電子元素表
価電子元素表なぜ化学が面白くないのか。
2015年10月12日
コメント(0)
-
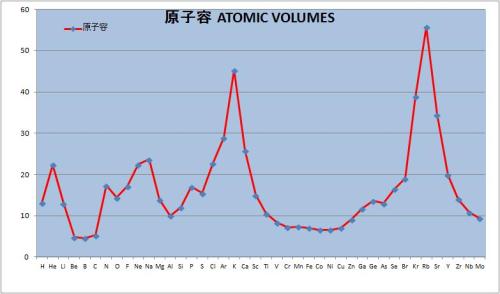
原子容
マイヤーが原子容曲線を発表したのは、1870年であった。現代のデータを元に原子容曲線を描いてみた。水素からモリブデンまで。
2015年10月01日
コメント(0)
-
Pauling's Rules
結晶構造の構築原理としてポーリングの規則がよく知られている。地球科学の父といわれるゴールドシュミットと同様の結論を得ている。Pauling's RulesRule 1 Around every cation, a coordination polyhedron of anions forms, in which the cation-anion distance is determined by the radius sums and the coordination number is determined by the radius ratio.1. Paulingの第1則:各陽イオンのまわりに,陰イオンが配位して多面体をつくる.その場合の陽イオン .陰イオン間の距離はそれらの半径の和により,また陽イオンの配位数は陽イオンと陰イオンの半径比により決まる.Rule 2, The Electrostatic Valency PrincipleAn ionic structure will be stable to the extent that the sum of the strengths of the electrostatic bonds that reach an ion equal the charge on that ion.2. Paulingの第2則(静電原子価則):安定な構造においては,陰イオンを取り囲むすべての隣接した陽イオンから陰イオンにとどく結合の総和が陰イオンのもつ電荷に等しい.Rule 3 Shared edges, and particularly faces of two anion polyhedra in a crystal structure decreases its stability.3. Paulingの第3則:構造中での 2個の陰イオン多面体に共通な稜,とくに共通な面の存在は,その構造を不安定にする.Rule 4 In a crystal structure containing several cations, those of high valency and small coordination number tend not to share polyhedral elements.4. Paulingの第4則:違った種類の陽イオンを含む結晶では,高い原子価で少ない配位数をもつ陽イオンは,たがいにそのまわりの多面体を共有しない傾向がある.Rule 5, The Principle of ParsimonyThe number of different kinds of constituents in a crystal tends to be small. 5. Paulingの第5則:一つの結晶中では,本質的に違った種類の構成要素の数は少なくなる傾向がある. The principles determining the structure of complex ionic crystals. J. Am. Chem. Soc. 51 (April 1929): 1010-1026
2015年09月18日
コメント(0)
-
塩素水和物
塩素の実験での化学史上で記憶にあるのは、1810年、デービーが塩素を取り込んで水との結晶物をつくる塩素包接水和物を発見し、1823年、マイケル・ファラディのこの塩素包接水和物の構成特定実験がよく知られている。この論文が、「 On Fluid Chlorine 」である。 論文の中では、Its composition is very nearly 27.7 chlorine, 72.3 water, or 1 proportional of chlorine, and 10 of water. とし1個の塩素分子と10個の水分子からなるCl2・10H2Oとしている。あまり知られてはいないが、ライナス・ポーリングに、1951年の論文「THE STRUCTURE OF CHLORINE HYDRATE」がある。ポーリングは、この塩素包接水和物について、X線構造解析により明らかにしている。1952年は、DNAの構造の研究に取りかかったころでもある。そしてこの塩素包接水和物の構造の詳細について考察した。水分子20個で構成された十二面体(この12面体には塩素分子は大きいため入っていない ) が2個と、塩素分子1個を包接した水分子24個で構成された十四面体が6個で形成されたクラスレートで、すなわち十二面体2個の周りを十四面体6個が取り囲んで構成されたクラスレートである。ポーリングは、更に詳細な構成比率として、6個の塩素分子と46個の水分子からなる6Cl2・46H2Oとしたのである。「On Fluid Chlorine 」 By M. Faraday Philosophical Transactions of the Royal Society of London Vol. 113 (1823), pp. 160-165「THE STRUCTURE OF CHLORINE HYDRATE」 By L. PAULING AND R.E. MARSH Proc Natl Acad Sci (1951) Feb; 38(2), pp.112–118.両論文とも入手可能。しかしながら、化学史上のいろいろな論文を調べているが、日本のサイトには、ほとんど見つからない。化学史という分野に興味をもつ人が少ないのが原因なのかどうなのか。化学史という分野に携わる人が少ないのが原因なのか。ポーリングの論文の冒頭はIn 1811 Humphry Davy showed that water is a component of the phase that had earlier been thought to be solidified chlorine, and twelve years later Michael Faraday reported an analysis that corresponds to the formula C12*10H20. He surmised that his determination of the chlorine content was low, and later studies have indicated the composition to be close to C12 8H20. 二百年も前に、マイケル・ファラディの出した結論が、数字として近い値であったかが、よくわかる。6Cl2・46H2O の構造は、イメージがなかなか湧かない。どういう構造でしょう。「HGS」でモデルができましたらアップします。
2015年09月03日
コメント(0)
-
原典の原点
化学史の探索に入ったきっかけを作ってくれたとも言うべき原典の原点A SUGGESTION LOOKING TO THE EXTENSION INTO SPACE OF THE STRUCTURAL FORMULAS AT PRESENT USED IN CHEMISTRY. AND A NOTE UPON THE RELATION BETWEEN THE OPTICAL ACTIVITY AND THE CHEMICAL CONSTITUTION OF ORGANIC COMPOUNDS. 1874やっと見つけることができました。ファントホッフの不斉炭素の立体結合理論十年ほど前にメタンの構造である正四面体を図面を書いて創り、結合角をエクセルで計算するのに、どう計算するのが、もっとも合理的か。これを一週間ほどパソコンでいじくり回した。彼が何故この考えに辿り着いたのか。この原典を読み解けば、その発想に近づけるのか。
2015年08月28日
コメント(0)
-
ラングミュア
アービング・ラングミュア(1881 – 1957) は、ルイスの電子構造理論をさらに掘り下げた論文を1919年に発表した。「THE ARRANGEMENT OF ELECTRONS IN ATOMS AND MOLECULES」がその論文だ。ラングミュアは、その冒頭で化学と物理の現状と役目を見事に語っている。周期表にさらに精密な構造を付け加えた。The problem of the structure of atoms has been attcked mainly by physicists who have given little consideration to the chemical properties which must ultimately be explained by a theory of atomic structure. The vast story of knowledge of chemical properties and relationships, such as is summarized by the Periodic Table, should serve as a better foundation for a theory of atomic structure than the relatively meager experimental data along purely physical lines. 原子構造の探求は、主に、最終的に原子構造の理論によって説明されなければならない化学的特性を、ほとんど検討しなかった物理学者によって取り組まれてきた。ネット上で入手できた関連論文の4編ラングミュア・「THE STRUCTURE OF ATOMS AND THE OCTET THEORY OF VALENCE」1919・「THE ARRANGEMENT OF ELECTRONS IN ATOMS AND MOLECULES」1919ルイス・「The Atom and the Molecule」1916コッセル・「Molecule Formation as a Question of Atomic Structure」1916
2015年08月23日
コメント(0)
-
ルイス 原子と分子
ぼつぼつ翻訳します。1916年発表のギルバート・ルイス氏の「原子と分子」にある仮定 1. In every atom is an essential kernel which remains unaltered in ordinary chemical changes and which possesses an excess of positive charges corresponding in number to the ordinal number of the group in the periodic table to which the element belongs. 1.すべての原子の基本中心核は、通常の化学変化に不変のままである。元素は、属する周期表の族の番号の数の原子価に応じた正電荷を持っている。 2. The atom is composed of the kernel and an outer atom or shell, which in the case of the neutral atom, contains negative electrons equal in number to the excess of positive charges of the kernel, but the number of electrons in the shell may vary during chemical change between 0 and 8. 2. 原子は、中心核と外側の原子またはシェルで構成される。中性原子の場合には、中心核の正電荷に等しい負電荷の電子をもっており、シェル内の電子の数は、化学変化に応じて0 から8 の値をとる。3. The atom tends to hold an even number of electrons in the shell and especially to hold eight electrons which are normally arranged symmetrically at the eight corners of a cube.3. 原子は殻内に偶数の電子を保持する傾向にあり、特に通常立方体の8隅に対称的に配置された8個までの電子を保持する傾向があります。4. Two atomic shells are mutually interpenetrable. 4. 二つの原子殻は、相互浸透の関係にある。5. Electrons may ordinarily pass with readiness from one position in the outer shell to another. Nevertheless they are held in position by more or less rigid constraints, and these positions and the magnitude of the constraints are determined by the nature of the atom and of such other atoms as are combined with it. 5.電子は通常、外殻にあれば、他の外殻へ簡単に移動することができます。しかし、電子は多かれ少なかれ制約によって位置を保持しており、これらの位置および制約の大きさは、原子とそれに結合した他の原子の性質によって決定されます。6. Electric forces between particles which are very close together do not obey the simple law of inverse squares which holds at greater distances.6. 互いに非常に接近している粒子間の電気力は、遠く離れているときの距離の二乗に反比例する力には支配されない。●ルイスの原子価理論。原子価と化学結合についての電子論。「原子の電子は、核を中心とし、正六面体の八頂点に配置されるものとし、すべての頂点が電子で占められると安定である。」とする理論。ルイス自身は「2個の原子は一方から他方に電子を移動させるだけでなく、一対またはそれ以上の電子の対を共有することによって、8の規則すなわち8隅則に従うことができる。2個の原子によって共有されている電子は、両方の原子の外殻に属していると見なしてよいだろう。」
2015年08月05日
コメント(0)
-
原子と分子
1916年にアメリカの物理化学者であるギルバート・ルイスは、化学結合(chemical bond)の理論を提案した。ルイスの「原子と分子」という論文の現代化学に与えた影響は多大であったと言われている。「The Atom and The Molecule」で検索をかけるとヒットしました。六つの仮定1. In every atom is an essential kernel which remains unaltered in ordinary chemical changes and which possesses an excess of positive charges corresponding in number to the ordinal number of the group in the periodic table to which the element belongs. 2. The atom is composed of the kernel and an outer atom or shell, which in the case of the neutral atom, contains negative electrons equal in number to the excess of positive charges of the kernel, but the number of electrons in the shell may vary during chemical change between 0 and 8. 3. The atom tends to hold an even number of electrons in the shell and especially to hold eight electrons which are normally arranged symmetrically at the eight corners of a cube.1 4. Two atomic shells are mutually interpenetrable. 5. Electrons may ordinarily pass with readiness from one position in the outer shell to another. Nevertheless they are held in position by more or less rigid constraints, and these positions and the magnitude of the constraints are determined by the nature of the atom and of such other atoms as are combined with it. 6. Electric forces between particles which are very close together do not obey the simple law of inverse squares which holds at greater distances. 翻訳は、・・・・・やや能力の限界を超えます。誰か翻訳していただけませんでしょうか。ぼつぼつ翻訳します。1. In every atom is an essential kernel which remains unaltered in ordinary chemical changes and which possesses an excess of positive charges corresponding in number to the ordinal number of the group in the periodic table to which the element belongs. 1.すべての原子の基本中心格核は、通常の化学変化に不変のままである。元素は、属する周期表の族の番号の数の原子価に応じた正電荷を持っている。
2015年07月23日
コメント(0)
-
周期表 12人衆
化学史の中で、ビッグイベントだった周期律を現した周期表に関わり登場する科学者達周期表 12人衆ヨハン・ヴォルフガング・デーベライナー(Johann Wolfgang Dobereiner, 1780年 - 1849年)は、ドイツの化学者。三つ組元素の発見者。ウイリアム・プラウト(William Prout 1785 - 1850)は、イギリスの医師・化学者である。1815年、彼は、( 元素が水素から成り,水素の原子量を単位とすれば他元素の原子量は整数になる )という「プラウトの仮説」を、打ち立てた。そしてこの仮説は、多くの科学者を虜にし、さまざまな影響を与えた。レオポルド・グメリン(Leopold Gmelin、1788年 - 1853年)は、ドイツゲッティンゲン出身の化学者である。1817年ハイデルベルグ大学の最初の化学の正教授となって、1851年引退するまで34年間正教授の地位にあった。そして、その正教授の後を引き継いだのはブンゼンである。V字型元素表。ローベルト・ヴィルヘルム・ブンゼン(Robert Wilhelm Bunsen、1811年 - 1899年)は、ドイツの化学者である。1852年レオポルド・グメリンの後をついでハイデルベルク大学理学部化学教室の第二代教授になった。ハイデルベルグ大学での門下生には、ロータル・マイヤー、アドルフ・フォン・バイヤー(滞在1856~1858年)、またドミトリ・メンデレーエフも1859年から2年間留学生として滞在した。自らが改良したバーナー(ブンゼンバーナーと呼ばれる)を利用して、グスタフ・キルヒホッフと共に、分光学的方法で1860年にセシウム、1861年にルビジウムを発見した。マックス・ヨーゼフ・フォン・ペッテンコーファー(Max Josef von Pettenkofer、1818年 - 1901年)は、ドイツ(バイエルン王国)の衛生学者、化学者。ベギエ・ド・シャンクルトア(Alexandre-Emile Beguyer de Chancourtois、1820年 - 1886年)はフランスの地質学者・鉱物学者である。メンデレーエフよりも前に元素の周期性を発見した一人である。グスタフ・ローベルト・キルヒホフ(Gustav Robert Kirchhoff, 1824年 - 1887年10月17日)は、プロイセン(現在のロシアのカリーニングラード州)生まれの物理学者。電気回路におけるキルヒホッフの法則、放射エネルギーについてのキルヒホッフの法則、反応熱についてのキルヒホッフの法則は、どれも彼によってまとめられた法則である。スタニズラオ・カニッツァーロ(Stanislao Cannizzaro, 1826年 - 1910年)は、イタリアの有機化学者、政治家。アヴォガドロの再評価を行い、周期表確立に貢献した。同時にイタリア統一運動に参加し、イタリア憲法の制定にも加わった。ユリウス・ロータル・マイヤー(Julius Lothar Meyer、1830年 - 1895年) は、ドイツの化学者・医師。1864年、マイヤーは28の元素を原子価(werthig)の値によって6つのグループに分け、かつ原子量の差を行ごとに算出した初期の周期表を発表した。なお当時、未知の元素であるゲルマニウムを空所とした周期表であった。ドミトリ・イヴァーノヴィチ・メンデレーエフ Dmitrij Ivanovich Mendelejev、1834年 -1907年1月20日)はロシアの化学者であり、元素の周期律表を作成し、それまでに発見されていた元素を並べ周期的に性質を同じくした元素が現れることを確認し、発見されていなかった数々の元素の存在を予言したことで知られており、メンデレビウムと元素名にも彼の名が残っている。ポール・ボアボードラン(ポール・エミール・(フランソワ)・ルコック・ド・ボアボードラン、Paul Emile (Francois) Lecoq de Boisbaudran、 1838年 - 1912年)はフランスの化学者。ガリウム(1875年)、サマリウム(1880年)、ジスプロシウム(1886年)の発見者である。レイリー卿 ジョン・ウィリアム・ストラット(英: John William Strutt, 3rd Baron Rayleigh、1842年 - 1919年)は、イギリスの物理学者。アルゴンの発見者。2015/7/11入手「Sketch of a course of chemical philosophy」興奮度90% カニッツーロ STANISLAO CANNIZZARO の著した「Sketch of a course of chemical philosophy」のPDFファイルを入手できました。カニッツーロが、アボガドロの仮説を如何に実証したか。「Sketch of a course of chemical philosophy」のなかの一節 p11The different quantities of the same element contained in different molecules are all whole multiples of one and the same quantity, which , always being entire, has the right to be called an atom.
2015年07月08日
コメント(0)
-

プラウト
ウイリアム・プラウト(William Prout 1785 - 1850)は、イギリスの医師・化学者である。1815年、彼は、( 元素が水素から成り,水素の原子量を単位とすれば他元素の原子量は整数になる )という「プラウトの仮説」を、打ち立てた。そしてこの仮説は、多くの科学者を虜にし、さまざまな影響を与えた。ドイツの科学者レオポルド・グメリンは、プラウトの仮説への支持を次の様に書き記している。 p32多くの物質の場合、化合する当量が水素の重量の整数倍なのは驚くべきことである。そして、すべての他の物質の化合量が、それらのうち最も小さいものの量で一様に割り切れることは自然の法則であろう。1827年プラウトの仮説に反対の立場のベルセリウスは、1827年に、元素の原子量を次の様に報告している。元素 H N Mg Na 原子量 1.06 14.2 25.3 46.5レイリー卿(ジョン・ウィリアム・ストラット) は、希ガス・アルゴンを発見した人物である。彼も、プラウトの仮説の信者の一人である。レイリー卿は、大気から酸素を除去して得た窒素が、化学的に生成した窒素よりも、密度が約1/1000小さいことに気づいた。この不可解な現象を、1892年にネイチャー誌に発表している。それから2年間、レイリーはラムゼーと共同でその原因を研究した。そしてついに空気中に存在する新元素アルゴンが不純物であることを突き止め、1895年に発表した。原子量は、偶然の一致によって辻褄があって説明されるより、はるかにぴったりと整数に近似される傾向にある・・・そのような偶然の一致で説明できるチャンスは1000分の1 より多くない。いずれにしても、この「プラウトの仮説」に対し、賛成の科学者も、反対の科学者も、様々な実験を繰り返し、元素の正確な原子量を求めて、周期表の完成へと近づいて行ったことが、科学者たちの大プロジェクトである周期表を生み出していったことに、間違いない。V字型元素表 1843ドイツの化学者レオポルド・グメリンは、1817年に当時の化学界で著名な教科書となった『無機化学ハンドブック』を著す。1843年『無機化学ハンドブック』4版で当時知られていた53個の元素をV字型にならべたV字型元素表を発表する。これら配列された元素表は主族元素をほとんど正しく族分類することに成功している。1817年ハイデルベルグ大学の最初の化学の正教授となって、1851年引退するまで34年間正教授の地位にあった。そして、その正教授の後を引き継いだのはブンゼンである。1843年に報告された 「グメリンのV字型元素表」グメリンのV字型元素表を族別に色分けグメリンがこのV字型元素表を発表したのは、カールスルーエの会議1860年より17年も前のことであるから、見事というほかない。まだ、分子という概念のない時代である。一定間隔で周期性を示すという特性を表に十分に盛り込めなかったため、評価はされなかった。また、グメリンは、「エステル」という名称の名付け親でもある。彼の著した「有機化学ハンドブック」の中で、エステルに関して言及している。b. エステルまたはオキシ酸エーテル 第三のエーテル酸素を結合するいくつかの無機酸および有機酸をアルコールと共存されると水を脱離して中性の揮発性エーテル化合物が形成する。これはアルコールと酸が結合した化合物、または、ラジカル理論で言うところの酸にエーテルが結合した塩と見ることができる。 【新品】【書籍・コミック 人文・思想・社会】メンデレーエフ 元素の周期律の発見者価格:648円(税込、送料別)
2015年07月04日
コメント(0)
-

にじ
5/22 全国的に現れた光景
2015年05月24日
コメント(1)
-
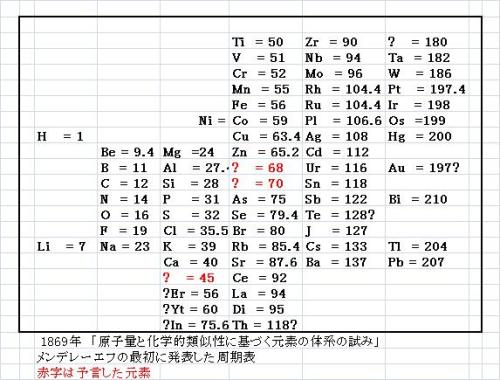
メンデレーエフの野望 1869年周期表
メンデレーエフの結論は1. 元素は原子量の順に並べると明らかにその性質ごとの周期性を表す。2. 化学的特性の類似する元素はほぼ同じ原子量であるか(例:白金、イリジウム、オスミウム)、原子量が規則的に増加するか(例:カリウム、ルビジウム、セシウム)である。3. 元素グループ内での原子量順に並べた元素の配列はいわゆる原子価だけでなく、ある範囲まで、独特の化学的特性と一致する。4. 広範囲に存在している元素の原子量は小さい。5. 分子の大きさが化合物の性質を決定するように、原子量の大きさが元素の性質を決定する。6. 未知の元素の発見が期待される。たとえば、共に原子量が65から75の間であり、化学的特性がアルミニウムに類似する元素およびケイ素に類似する元素が存在するであろう(後年、該当するガリウム、ゲルマニウムが発見される)。7. 元素の原子量は原子番号順で前後する元素の原子量に関する知識により修正できることがある。たとえば、テルルの原子量は123から126の間にあり、128にはなりえない。8. 元素の特徴的な特性はその原子量から予言できる。 wikipedia より 「周期表」p1251. The elements, if arranged according to their atomic mass, exhibit an apparent periodicity of properties.2. Elements which are similar as regards to their chemical properties have atomic weights which are either of nearly the same value (e.g., Pt, Ir, Os) or which increase regularly (e.g., K, Rb, Cs).3. The arrangement of the elements, or of groups of elements in the order of their atomic masses, corresponds to their so-called valencies, as well as, to some extent, to their distinctive chemical properties; as is apparent among other series in that of Li, Be, B, C, N, O, and F.4. The elements which are the most widely diffused have small atomic weights.5. The magnitude of the atomic weight determines the character of the element, just as the magnitude of the molecule determines the character of a compound body.6. We must expect the discovery of many yet unknown elements – for example, elements analogous to aluminium and silicon – whose atomic weight would be between 65 and 75.7. The atomic weight of an element may sometimes be amended by a knowledge of those of its contiguous elements. Thus the atomic weight of tellurium must lie between 123 and 126, and cannot be 128.8. Certain characteristic properties of elements can be foretold from their atomic masses. メンデレーエフが予想した元素 ?=45(エカ・ホウ素) ?=68(エカ・アルミニウム) ?=70(エカ・ケイ素) の3元素?=45、?=68、?=70 がメンデレーエフの壮大な野望であり、壮大な仕掛けであった。発表した1869年時に、ほとんど反響なし。エカ・アルミニウムとしていたガリウムは、1875年にフランスのボアボードランによって発見、雑誌で報告した。これに対して、メンデレーエフは、彼が予言した元素エカ・アルミニウムであると主張したのだ。 エカ・ホウ素としていたスカンジウムは、1879年にスウェーデンのニルソンによって、エカ・ケイ素としていたゲルマニウムは、1886年にドイツのヴィンクラーによって発見された。
2015年05月07日
コメント(0)
-

V字型元素表
V字型元素表 1843ドイツの化学者レオポルド・グメリンは、1817年に当時の化学界で著名な教科書となった『無機化学ハンドブック』を著す。1843年『無機化学ハンドブック』4版で当時知られていた53個の元素をV字型にならべたV字型元素表を発表する。これら配列された元素表は主族元素をほとんど正しく族分類することに成功している。1843年に報告された 「グメリンのV字型元素表」グメリンのV字型元素表を族別に色分けグメリンがこのV字型元素表を発表したのは、カールスルーエの会議1860年より17年も前のことであるから、見事というほかない。まだ、分子という概念のない時代である。一定間隔で周期性を示すという特性を表に十分に盛り込めなかったため、評価はされなかった。また、グメリンは、「エステル」という名称の名付け親でもある。彼の著した「有機化学ハンドブック」の中で、エステルに関して言及している。b. エステルまたはオキシ酸エーテル 第三のエーテル酸素を結合するいくつかの無機酸および有機酸をアルコールと共存されると水を脱離して中性の揮発性エーテル化合物が形成する。これはアルコールと酸が結合した化合物、または、ラジカル理論で言うところの酸にエーテルが結合した塩と見ることができる。 【新品】【書籍・コミック 人文・思想・社会】メンデレーエフ 元素の周期律の発見者価格:648円(税込、送料別)
2015年05月01日
コメント(0)
-

三つ組元素・・ デービーからデーベライナーへ
メンデレーエフの周期表に至るまでには、さまざまな化学者の試みが、行われていた。周期表に至る最初の発想は、三つ組元素という性質の類似した元素分類から始まったといってもいいだろう。十九世紀のはじめは、元素発見のラッシュの時代であった。イギリスのハンフリー・デービー(1778-1829)は、この元素発見ラッシュの火付け役と言ってもよい。ボルタ電池を使用した溶融電気分解により、多くの元素を発見した。ボルタ電池は、この元素発見に革命をもたらした。Ca-Sr-Baの3元素の発見は、デービーによるものであった。 Ca・・1808年、ハンフリー・デービーが生石灰を酸化水銀とともに溶融電解し、金属カルシウムを得ることに成功した。 Sr・・金属ストロンチウムは1808年、ハンフリー・デービーにより、電解法を用いて単離される。 Ba・・1808年、ハンフリー・デービーがバリウム塩の溶融塩電解によってバリウムの単体を初めて単離した。デービーはバリウム (barium)と名付けた。このデービーのCa-Sr-Baの発見は、三つ組元素の発見へと繋がっていく。 ドイツのヨハン・デーベライナー(1780-1849)は、1817年頃Ca-Sr-Baの3元素の酸化物の原子量を考えて、SrOの原子量はCaOとBaOとの平均値にほぼ等しいことを指摘した。 SrO = (CaO + BaO)/2 = 107 = (59+ 155)/2 さらに、12年後の1829年に三組の三つ組元素(triad)を報告している。Cl-Br-I , Li-Na-K , S-Se-Te 現在では解っているハロゲン元素、アルカリ金属元素、カルコゲン元素である。発見されて間もない元素を見事に分類している。Se セレン・・・1817年にベルセリウスにより発見。ベルセリウスにより命名。セレン(selene) ギリシャ神話で月の女神の名前。Te テルル・・・1782年ミュラーにより分離。テルル(Tellus)ローマ神話で大地の女神の名前。Br臭素・・・・・1826年にフランスの化学者バラールが発見。**「周期表」 シェリー著 渡辺正訳 丸善出版 【新品】【書籍・コミック 医学・科学・技術】周期表 いまも進化中価格:1,080円(税込、送料別)
2015年04月01日
コメント(0)
-
兼聴則明
兼聴則明 あわせきけば すなわちあかるく偏信則暗 かたよりしんずれば すなわちくらし
2015年04月01日
コメント(0)
-
水素社会
水素が、キャベンディッシュによって発見されたのが、1766年。シャルルが水素で、気球を飛ばしたのが、1786年。経済産業省から「水素・燃料電池戦略ロードマップ」、独立行政法人 新エネルギー・産業技術総合開発機構から「NEDO 水素エネルギー白書 2014」が2014年に報告され、いよいよ本格的に、水素社会の幕開けを予感する報道が相次いでいる。水素社会のMIRAIは近いのか、遠いのか。「水素・燃料電池戦略ロードマップ」http://www.meti.go.jp/press/2014/06/20140624004/20140624004-2.pdf「NEDO 水素エネルギー白書 2014」 http://www.nedo.go.jp/content/100567362.pdf 水素エネルギー白書の内容水素エネルギー白書 2014 NEDO 水素エネルギー白書 ~水素社会実現のために~ 目次はじめに .................................................................. 1第 1章水素とはなにか ...................................................... 2 1-1水素とは ............................................................... 2 1-2水素エネルギーを導入する意義 ........................................... 4第 2章水素エネルギーに関連する日本の政策と取り組み ........................ 8 2-1水素エネルギーに関する日本の政策 ....................................... 8 2-2我が国の水素エネルギーに関する取り組み ................................ 13第 3章水素エネルギーに関連する各国の取組み ............................... 45 3-1主要国の取り組み ...................................................... 45 3-2国際協調の取り組み .................................................... 53 3-3水素エネルギーに係る国際会議 .......................................... 58第 4章水素エネルギーの市場の現状と展望 ................................... 60 4-1水素市場の展望 ........................................................ 60 4-2定置用燃料電池 ........................................................ 60 4-3燃料電池自動車 ........................................................ 65 4-4水素供給インフラ....................................................... 67 4-5水素ステーション ...................................................... 70第 5章水素エネルギーの社会受容性 ......................................... 72 5-1水素の性質 ............................................................ 72 5-2水素の安全利用のための規制 ............................................ 73 5-3水素に関する安全対策の現状 ............................................ 75 5-4水素の社会受容性 ...................................................... 79第 6章水素エネルギー技術 ................................................. 82 6-1水素エネルギー技術の全体像 ............................................ 82 6-2水素製造技術 .......................................................... 84 6-3水素輸送・貯蔵技術 .................................................... 98 6-4水素供給技術 ..........................................................117 6-5水素利用技術 ......................................................... 121第 7章水素社会実現を目指して ............................................ 147 7-1水素社会実現に向けた課題 ............................................. 147 7-2課題克服に向けた取り組み ............................................. 150 7-3まとめ................................................................ 153第 8章用語集 ............................................................ 154第 9章参考資料 .......................................................... 162 人類は、「水素」をまだ使っているとは言えない。
2015年01月17日
コメント(0)
-

三十三間堂
今年も、準備がすすんでいました。2015.1.142015.1.18
2015年01月17日
コメント(0)
-

1814年生まれ ピリア 7
200年前1814年生まれであるラファェレ・ピリア(イタリア)。日本でも、「歯痛に柳楊枝」として知られている柳の皮の解熱作用。この解熱成分を分離しサリシンと命名(1830年)、そしてサリシンから分解しサリチル酸を単離したのが、ピリアである。コルベシュミット反応で名高いヘルマン・コルベ氏は、サリチル酸の合成法を確立した(1853)。 このコルベ氏は、ファントホッフが、メタン正四面体構造説を発表した際の悪口雑言でも超有名である。柳楊枝に関する行事は、日本に今でも受け継がれている。毎年1月15日に「楊枝浄水供」という法要が京都の三十三間堂で行われている。寺の大切な法要で、後白川法皇の頭痛平癒に起源するものと言われる行事である。
2014年11月21日
コメント(0)
-
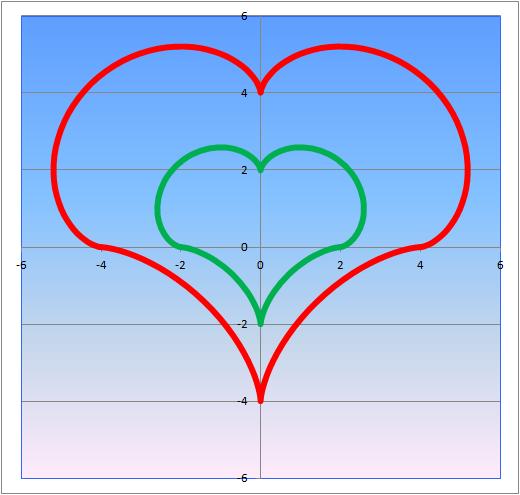
ハート曲線
2つの曲線関数から合成しています。何の曲線の組み合わせでしょうか。
2014年11月09日
コメント(0)
-
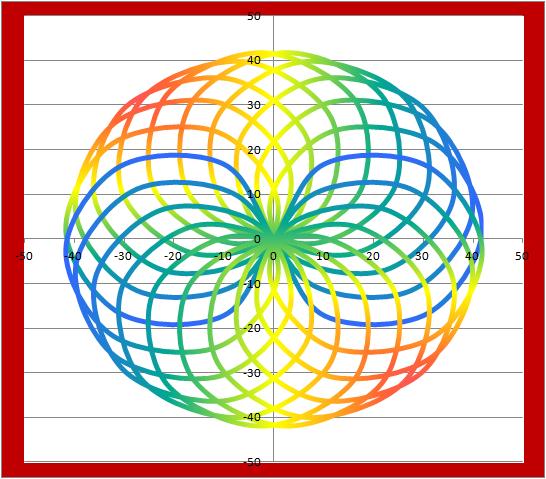
二十連 マルチ
二十連20連 エピトロコロイド_マルチdot point 129 21*cos$-21*cos(21$) 21*sin$-21*sin(21$)
2014年11月09日
コメント(0)
-

八連
八連六連
2014年11月07日
コメント(0)
-

4連
3cos$+0.5cos3$3sin$-0.5sin3$3cos$+cos3$3sin$-sin3$3cos$+1.5cos3$3sin$-1.5sin3$3cos$+2cos3$3sin$-2sin3$5cos$-cos5$5sin$-sin5$円錐曲線論-【電子書籍】価格:2,700円
2014年10月25日
コメント(0)
-
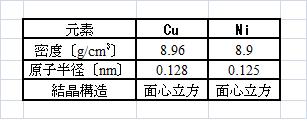
Cu 質量 と Ni 質量
質量 原子量娘の高校入試の問題にNaClのモル質量を、イオン半径と密度から求める問題があった。解いたあと、遷移元素に密度と原子半径の数字が載っている表が見つかった。何となくこの数字から原子量が出せそうだな。「これは解く価値がありそうだ」大胆にも考えた。大袈裟ですな。 表01Cuの質量を計算して見よう。面心立方格子構造の金属の場合、原子の配置は、正方形に図のような原子の並び方になる。図01原子半径= rより、面心立方格子の格子定数(格子間距離)= aを、まず算出する。 表02a = (4/√2) x 0.128 nm = 0.362 nm 密度〔g/cm3〕ρ= 8.96 と アボガドロ数NA = 6.02*10^23 から 4M = ρ*a^3*NA 式(1) 従って、銅の M = 63.9 Ni の場合は、M = 59.2と計算された。この結果を、娘を言うと、「あ、そう。」で終わってしまった。
2014年10月19日
コメント(0)
-
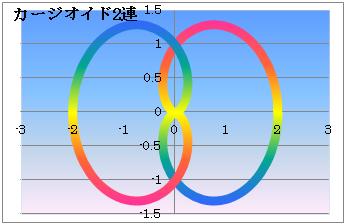
カージオイド
x =(1+cos$)cos$y =(1+cos$)sin$
2014年10月16日
コメント(0)
-
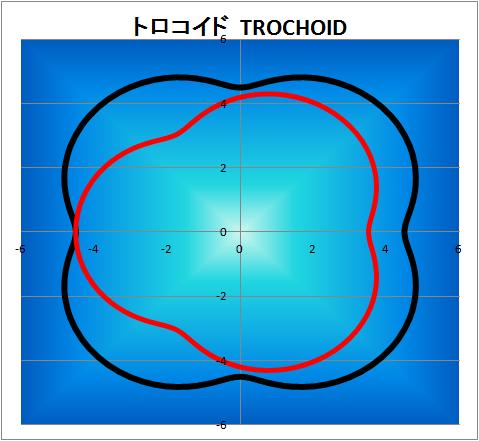
トロコイド
トロコイド曲線ポンプなどに見られる曲線です。
2014年09月11日
コメント(0)
-
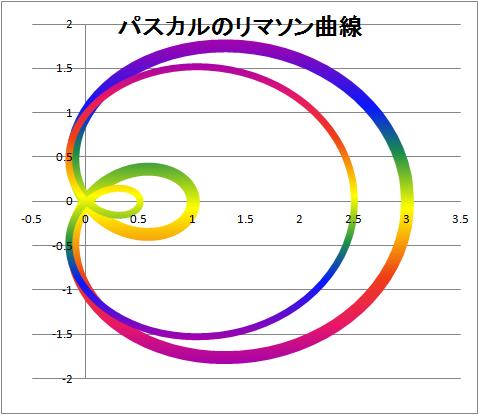
リマソン曲線2
★パスカル リマソン曲線カラー版系列を、系列1、系列2と二通りにし、色を上下逆に★リマソン カージオイド曲線リマソン曲線にカージオイド曲線を合体系列を、系列1、系列2とし、リマソン曲線と、カージオイド曲線を描く。パスカルの定理のグラフ表示を計画中
2014年08月24日
コメント(0)
-
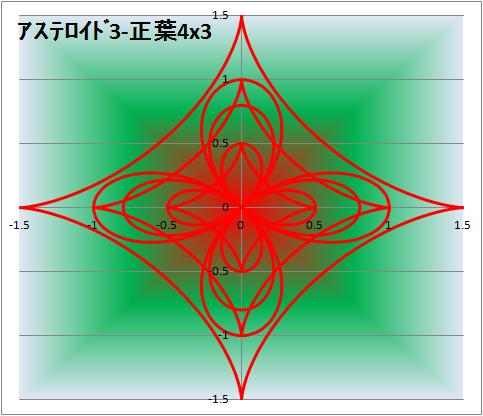
アステロイド + 虹円
アステロイド ローズこのアートにはまってしまいました。
2014年08月02日
コメント(0)
-
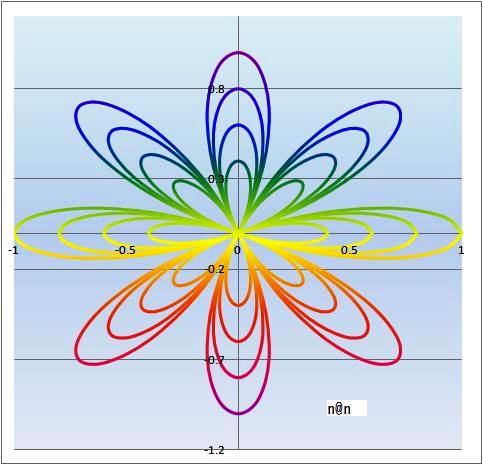
正葉曲線 8 x 4
正葉曲線エクセルで美しいグラフアートは、どこまで描けるでしょうか。8花弁で挑戦しました。
2014年07月30日
コメント(0)
-
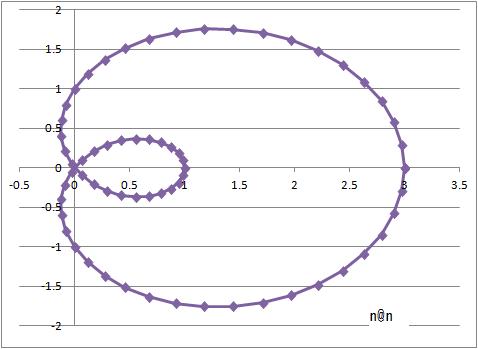
パスカルのリマソン曲線
蝸牛線ともいう。格律 パスカルの隠し絵 (小柳氏)に記載の7格律 1.あらゆる物体は、たがいに離れること、たがいの間にこの見かけの真空を許容することをいやがっている。すなわち、自然はこの見かけの真空を恐れている。 2.あらゆる物体がもっているこの恐怖(horreur)、あるいはこの嫌悪(repugnance)の度合いは、大きな見かけの真空を許容するときのほうが小さな真空のときよりも大きいわけではない。すなわち小さなへだたりをもつて遠ざかるときよりも大きなへだたりをもって遠ざかるときに、より大きいわけではない。 3.この恐怖の力は限られていて、ある一定の高さ、それはおよそ31ピエであるが、その高さの水が、それをもって下へ流れ落ちようとするときの力にひとしい。 4.この見かけの真空と接している物体は真空を満たそうとする傾向を有する。 5.この傾向の度合いは、大きな見かけの真空を満たすときのほうが小さな真空のときよりも強いわけではない。 6.この傾向の力は限られていて、ある一定の高さ、それはおよそ31ピエであるが、その高さの水が、それをもって下へ流れ落ちようとする力にひとしい。 7.それをもって31ピエの高さの水が下へ流れ落ちようとするその力よりも、ほんの少しでも大きい力があれば、この見かけの真空を、それを望むだけのどんなに大きさでも、許容されるに足りる。すなわち、物体を望むだけ大きなへだたりをもって引き離されるに足りる。このときそれらの分離や遠ざかりにとって、自然がこの見かけの真空に対して抱いている恐怖以外のどんな障害もないならばのことであるが。
2014年07月26日
コメント(0)
-

菱形十二面体
ヘキサメチレンテトラミン から 菱形十二面体
2014年07月22日
コメント(0)
-

ヘキサメチレンテトラミン
ヘキサメチレンテトラミン
2014年07月18日
コメント(0)
-
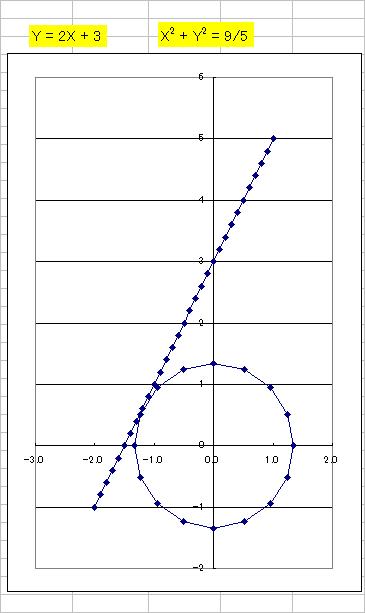
円 と 接線 そして 法線
円と接線をエクセルで描くまあまあの出来です。下記が、円の入力式接線と接線
2014年07月10日
コメント(0)
-
ガリレオ
ガリレオ・ガリレイ著「新科学対話」岩波文庫、から引用。「第一日」のところに、この会話がある。P40サグレド:有難う。この議論のお陰で、私は長い間疑問に思っていて、また到底理解できないと諦めていたある現象の原因が分りました。かつて私はポンプのついている井戸をみて、水はこうすれば普通のバケツよりも力も要らなく、又はるかに多量に汲む事ができると、誤った感銘を受けていたのです。このポンプでは管の上に吸い子と弁があって水は、吸い子が下にあるポンプのように押し上げられるのではなく、引っぱり上げられるのでした。このポンプは井戸の水面がある決まった高さ以上にある時には完全な働きをしましたが、その高さ以下のときには用をなしませんでした。最初この現象を認めたとき、私は機械に狂いができたのだと思ったのです。ところが修繕に呼んで来た職人は、故障はポンプにあるのではなく、水にあるのです、水位があまり低くなったのでこんな高所には水が揚がらないのだといいました。それに付け加えて彼は、ポンプでも何でも吸引力の原理によって働くものは18キュービット以上は毛幅の高さも水を揚げることはできない。ポンプが大きかろうと小さかろうと、これが水の揚がる限度だ、といいました。・・・サルヴィヤチ:事実は全くその通りなのです。ポンプが大であろうと、小であろうと、あるいは、更にムギワラのように細かろうとも、どれ程の水量でも必ずこの18キュービットまでは揚がります。そこで、直径に関係なく18キュービットの管の中に含まれた水の重さをはかれば、これと同じ直径の任意の固体の円柱の真空抵抗力の値が得られる、といえるのです。・・・ 「1キュービット」・・・50±5cm
2014年07月09日
コメント(0)
-
バックミンスター・フラー
バックミンスター・フラーからの詩 それぞれの人にとって環境とは、 「私を除いて存在する全て」 であるにちがいない。 それに対して宇宙は、 「私を含んで存在する全て」 であるにちがいない。 環境と宇宙の間のたった一つのちがいは、私・・・・・ 見る人、為す人、考える人、愛する人、受ける人である私 Envirronment to each must be "All that is excepting me." Universe in turn must be "All that is including me." The only difference between environment and univerce is me .... The observer, doer, thinker, lover, enjoyer 「脳を鍛える」(立花隆)からの抜粋全体的に思考して、 局所的に行動せよ。 最小限を行使しつつ、 最大限を達成せよ。
2014年07月06日
コメント(0)
-

隠し絵
・著者: 小柳公代 ・レーベル: 中公新書 ・シリーズ名: パスカルの隠し絵 実験記述にひそむ謎 ・発売日: 2012年12月19日 ・出版社: 中央公論新社 ・商品番号: 4911363740001 ・言語: 日本語 ・対応端末: 電子ブックリーダー, Android, iPhone, iPad 商品の詳細説明 「人間は考える葦である」という言葉で有名な『パンセ』の作者パスカルは、天才的数学者、厳密な実験物理学者としても知られている。とりわけ十七世紀までヨーロッパ自然学の大前提であった〈真空不可能〉説を打ち破る大実験を行い、揺るぎない理論を提出したことで名高い。しかしそこには、謎めいた印象が否めない。パスカルは本当に実験したのか。彼の物理論文には、『パンセ』と同じ文学作品としての仕掛けを読み取るべきではないか。 パスカルの隠し絵 実験記述にひそむ謎-【電子書籍】価格:600円パスカルの「科学論文集」は、1953年に発行されており、入手できないとおもっていたら、ネットで調査すると古本が入手可能であった。探して見るものです。
2014年07月04日
コメント(0)
-
我が真空
何故こうも、真空に対して拘るのか。そして執着するのか。やはり、何年もの間、真空による縮合合成に携わっていたからである。それも、全くの素人から、教えを請う人すら周りに1人としていなかった。さらに、300℃近い高温反応である。実験道具を揃え、そして作っていく作業の繰り返しであった。
2014年07月03日
コメント(0)
-

数学論文集
パスカル数学論文集(ちくま学芸文庫)【楽天ブックスならいつでも送料無料】パスカル数学論文集 [ ブレーズ・パスカル ]価格:1,620円(税込、送料込)【内容情報】(「BOOK」データベースより)『パンセ』に息づく数学の精神とは。「円錐曲線試論」「数三角形論」「幾何学的精神について」など収録。【目次】(「BOOK」データベースより)円錐曲線試論/巾数ノ和/数3角形論/単位数を母数とする数3角形の様々な応用/数序列論/連続数ノ積ニツイテ/巾数ノ一般的解法/A.デトンヴィルからA.D.D.S.氏への手紙/A.デトンヴィルからド・カルカヴィ氏への手紙/直角3線形とその蹄状体との理論/単純和、3角和、ピラミッド和の性質/4分円の正弦論/円弧論/回転体小論/ルーレット一般論/あらゆるルーレットの曲線の長さ【著者情報】(「BOOK」データベースより)パスカル,ブレーズ(Pascal,Blaise)1623-1662年。フランス中部のクレルモン生まれ。幼少時から数学と自然学に才能を発揮し、16歳で「円錐曲線試論」を発表。その他加減算計算機の考案をはじめ数多くの業績を挙げた。1646年以降ジャンセニスムに接近し、1654年の回心を機に信仰に身を捧げることを決意したが、数学研究は続行した原亨吉(ハラコウキチ)1918-2012年。元大阪大学教授。パスカル数学研究により日本学士院賞・恩賜賞受賞(本データはこの書籍が刊行された当時に掲載されていたものです)
2014年06月13日
コメント(0)
-
パスカルの真空
パスカルの真空7原則「真空に関する新実験」結果要約部分の7箇条の部分を、松浪氏の「パスカル科学論文集」、大出氏の「物理学者パスカル」と小柳氏の「パスカルの隠し絵」から引用し記載する。原則 パスカル科学論文集(松浪氏) に記載の真空7原則1.あらゆる物体は、互いに分離してその中間に見かけの空所のはいりこむことを、嫌悪する傾向をもっている。いいかえれば、自然は見かけの空所を怖れている。2.あらゆる物体が有するかかる怖れ、もしくはこの嫌悪は、見かけの空所が小さいときよりも大きいときに、いつそう甚だしいというようなことはない。いいかえれば、その中間の場所の大小の如何にかかわらず、一様の強さで、これを避けようとする。3.この怖れの強さには、しかし、限度がある。それは、一定の高さすなわちおおむね31ビエの高さの水が下方に流れようとする強さに相當する強さである。4.この見かけの空所に接している物体は、そこを満たそうとする傾向を有する。5.空所を満たそうとするこの傾向は、見かけの空所が小さいときよりもより大きいときに、一そう強いというようなことはない。6.この傾向の強さには、おのずから限度がある。そしてそれは、一定の高さすなわちおおむね31ビエの高さの水が下方に流れようとする強さに、つねに相當する強さである。7.31ビエの高さの水が下方に流れようとする強さよりも、ほんの少しでも強さが増せば、この増しただけの強さで以て、いかに大きな見かけの空所をも生じさせるのに十分である。いいかえれば、この見かけの空所に対して自然がいだいている怖れのほかに、物体の分離や疎隔を妨げるものが何も存在しないならば、増しただけの強さで、物体を分離させ、いかに大きな空間をも生じさせることができる。準則 物理学者パスカル(大出氏) に記載の7準則1.あらゆる物体はたがいに引きはなされて、それらのあいだに見かけの空虚を認めることを嫌悪する。つまり、自然はこの見かけの空虚をはなはだしく嫌悪する。 2.あらゆる物体のもつこの恐怖(horreur)あるいは、嫌悪(repugnance)は、大きな見かけの空虚と小さなそれを認めるのでは、いいかえれば、大きな間隔と小さな間隔で隔てられるのでは、差がない。 3.この恐怖の力には限界があり、約31ピエ(pieds,1pied≒33・3mm)の高さの水が流れ落ちようとする力に匹敵する。 4.この見かけの空虚を囲む物体はそれを満たそうとする傾向をもつ。5.この傾向は大きな見かけの空虚を満たすのと小さなそれを満たすのでは、強さが等しい。 6.この傾向の力は限界をもち、約31ピエの高さの水が流れ落ちようとする力に匹敵する。7. 31ピエの高さの水が流れ落ちようとする力をどんなにわずかでも越える力は、この見かけの空虚を、それがどんなに大きくとも、認めさせるのに、十分である。いいかえれば、自然がこの見かけの空虚に対してもつところの恐怖以外に、それらを離すのにも、遠ざけるのにも障害がないのであれば、どんなに大きな間隔で物体を引きはなすのにも、それは十分である。格律 パスカルの隠し絵 (小柳氏)に記載の7格律1.あらゆる物体は、たがいに離れること、たがいの間にこの見かけの真空を許容することをいやがっている。すなわち、自然はこの見かけの真空を恐れている。 2.あらゆる物体がもっているこの恐怖(horreur)、あるいはこの嫌悪(repugnance)の度合いは、大きな見かけの真空を許容するときのほうが小さな真空のときよりも大きいわけではない。すなわち小さなへだたりをもつて遠ざかるときよりも大きなへだたりをもって遠ざかるときに、より大きいわけではない。 3.この恐怖の力は限られていて、ある一定の高さ、それはおよそ31ピエであるが、その高さの水が、それをもって下へ流れ落ちようとするときの力にひとしい。 4.この見かけの真空と接している物体は真空を満たそうとする傾向を有する。 5.この傾向の度合いは、大きな見かけの真空を満たすときのほうが小さな真空のときよりも強いわけではない。 6.この傾向の力は限られていて、ある一定の高さ、それはおよそ31ピエであるが、その高さの水が、それをもって下へ流れ落ちようとする力にひとしい。 7.それをもって31ピエの高さの水が下へ流れ落ちようとするその力よりも、ほんの少しでも大きい力があれば、この見かけの真空を、それを望むだけのどんなに大きさでも、許容されるに足りる。すなわち、物体を望むだけ大きなへだたりをもって引き離されるに足りる。このときそれらの分離や遠ざかりにとって、自然がこの見かけの真空に対して抱いている恐怖以外のどんな障害もないならばのことであるが。最も肝心の真空が発現した空間に対する表記は見かけの空所・・・松浪氏見かけの空虚・・・大出氏見かけの真空・・・小柳氏と三者三様となっている。
2014年05月15日
コメント(0)
-
仮説
パスカルの「仮説」すでに知られているいくつかの現象の原因を発見するためにある仮説がおかれるたびごとに、この仮説は三種類のどれかでありえます。なぜなら、仮説の否定から明らかな非合理を結論することがたびたびありますが、そのとき、その仮説は真であり、確かです。あるいは、その肯定から明らかな非合理が結論されますが、そのとき、その仮説は偽と見なされます。その否定からも、肯定からもまだ非合理を引き出せないときには、その仮説は疑わしいままであるからです。したがって、ある仮説が疑う余地のないものであるようにするには、あらゆる現象がそれから結果するというのでは十分ではなくて、そのかわりに、もし現象のうちのただひとつにも反するなにかが結果するのであれば、その仮説を偽として確信するには、それで十分なのです。「物理学者パスカル」の中のパスカルの語る「仮説」 大出晁氏「合理的で最も有力な仮説」は、「正説」とならねばならない。
2014年04月27日
コメント(0)
-

「ローソクの科学」の some one
ファラディは、「ロウソクの科学」という著作に見られるように、生涯多くの講演をこなしている。ファラディのクリスマス講演は1827年の「化学」から始まって、この「ロウソクの科学」「The Chemical History of a Candle」は1860年におこなわれた最後のクリスマス講演である。「ロウソクの科学」は1861年に出版されて、150年以上も読み継がれているベストセラーである。岩波文庫等を入手できる。 ローソクの科学の第1講の以下でのゲイ・リュサックが出てくる部分で which Gay Lussac, or some one Mr. Field, of Lambeth, has supplied me abundantly with beautiful illustrations of the candle and its materials. I shall therefore now refer to them. And, first, there is the suet—the fat of the ox—Russian tallow, I believe, employed in the manufacture of these dips, which Gay Lussac, or some one who entrusted him with his knowledge, converted into that beautiful substance, stearin, which you see lying beside it. この'some one' が誰かと言うところで、気になり調査したところ、ユストゥス・フォン・リービッヒ と エドモンド・フレミーが候補として考えられる。 脂肪の鹸化についての研究を行い、1850年にはゲイ・リュサックの跡をついでパリ植物園の教授(化学)に就いている人物。この人物は??????Mr. Fieldについては、訳注にある。ランベスにロウソクの工場をもつフィールド家岩波文庫 33−909−1【1000円以上送料無料】ロウソクの科学/ファラデー/竹内敬人価格:735円(税5%込、送料別)「ロウソクの科学」は、ネットで、日本語訳 英文を入手できる。当初、英文は簡単には入手できないと思っていた。しかし、なんでもやってみるもんだ。
2014年03月21日
コメント(1)
-

水素
★ 水素 水素の歴史上の記載は、16世紀 錬金術師パラケルスス(スイス)は、硫酸と鉄の反応で気体が発生することを見つけている。またイギリスでは、ボイルが、1671年に鉄くずに酸を加えると、可燃性の気体が発生することを書き残している。 「水素がわかる本」1766年、キャベンデッシュは、鉄Fe・亜鉛Zn、銅Cuを酸(硫酸 塩酸)に浸し、発生した気体を捕集し、空気よりも「軽い気体」を発見する。このときの「気体」は簡単に火がついたので、彼はこの気体を「可燃性空気」と名付けた。これが後に水素と言われる気体だ。そして、プリーストリーは、1781年に水素と酸素の燃焼によって水ができることを証明し、1783年にラボアジエがこの「可燃性空気」を「水素」と命名することによって、ようやく元素の一つとなった。水素の気球を初めて成功さしたのは、シャルルであった。そして現代では、水から水素をつくる触媒の研究が進んでいる。【中古】 水素がわかる本 /小波秀雄(著者) 【中古】afb価格:750円(税5%込、送料別)化学と歴史とミステリー価格:1,470円(税5%込、送料別)
2014年03月21日
コメント(0)
全893件 (893件中 1-50件目)
-
-

- φ(._.)主婦のつぶやき☆
- 超極細繊維のあっちこっちふきんナノ
- (2024-11-27 23:44:45)
-
-
-

- 私なりのインテリア/節約/収納術
- najimuiさんのクリスマスポストカー…
- (2024-11-27 18:25:38)
-
-
-

- 仕事しごとシゴト
- バー小林の24/11/27
- (2024-11-28 08:38:07)
-








