2018年11月の記事
全12件 (12件中 1-12件目)
1
-

より軽く手抜きしてー熱気球演示実験→PV=nRT
昨年も行いましたが、熱気球演示実験。熱気球演示実験→PV=nRT→2017/11/17ブログ出来るだけ、簡単にポリゴミ袋で熱気球を作りました。で、作ったのはこれ。メタノールに硫酸銅(Ⅱ)を少し入れて、青い炎が出るようにしました。DAISOのゴミ袋を使っています。もっとも軽くて簡単に浮きます。枠は細いピアノ線を使っています。コシがあり、袋の口をしっかり広げてくれます。この枠をゴミ袋の口に当てて、貼りしろを折り返してセロテープで止めます。昨年はこの枠にさらにピアノ線を十字にはり、中央に脱脂綿を絡めましたが、今年は、細いエナメル線(銅)1本を交差させてセロテープで止め、ここに脱脂綿をからめました。これにより、袋の口付近に炎が位置するので、熱が逃げにくくなりました。上は必ず失敗する東京都指定ゴミ袋(燃料抜きで18g)、DAISOゴミ袋(燃料抜きで8g)に比べてとても重い。今回は教室で上げました。生徒から歓声をいただきました。天井について、しばらく落ちてきません。そして、空気(気体)の浮力の話。レポートを書いてもらいこの演示実験を終えます。気球の上のところに熱がたまるので、ちりめんのようになりますが、2クラスであげてもまだ使えそうです。毎年ゴミ袋を取り替えて使っています。
2018.11.30
コメント(0)
-

実験レポート:気体の状態方程式を使った分子量測定
生徒実験:気体の状態方程式を使った分子量測定→11/28ブログ昨日行った実験「気体の状態方程式を使った分子量測定」生徒のレポートを回収しました。実験の詳細については予備実験:気体の状態方程式を使った分子量測定→11/23ブログをご覧ください。さて、レポートです。はじめに、予備実験の記録と計算です。このような、レポートを生徒に書いてもらいました。結果は以下です。2クラス計18班について、一覧にし、誤差を示してあります。昨年に比べて、とても誤差の少ない結果となりました。昨年との比較をヒストグラムにします。判明している、誤差が大きな実験については上に示します。昨年は、①完全に気化を確認せず次の操作に移った(誤差7%以上の班)②アルミホイルに開けた穴が大きすぎた③冷却し液化するまでにフラスコを傾けすぎて気体CCl4がこぼれてしまった(②③は誤差がマイナス)この点を今年は、強く注意したのが、良い結果を生んだと思います。定量実験では、どんな実験でも誤差±5%以内(できれば±3%以内)になるように工夫することを心がけています。やっと、この実験も生徒に安心して行える実験になってきました。
2018.11.29
コメント(0)
-
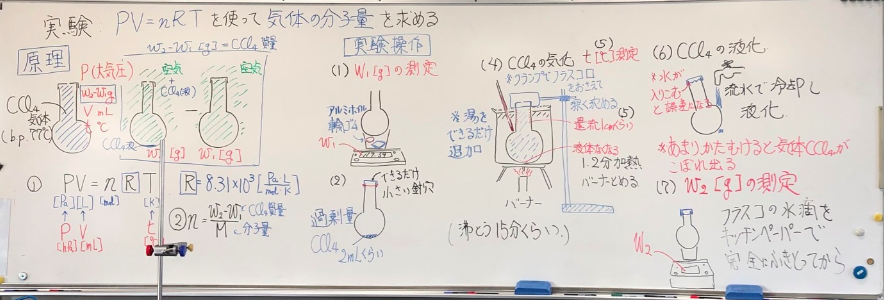
生徒実験:気体の状態方程式を使った分子量測定
予備実験:気体の状態方程式を使った分子量測定→18/11/23ブログの生徒実験を行いました。原理と実験操作の説明説明です。実験書はリンクの予備実験にページに示してありますのでそちらをご覧ください。また、生徒には予備実験で検討した注意事項を伝えて、実験してもらいました。レポート(実験書の裏面)の提出は明日です。レポートを評価したら、アップします。
2018.11.28
コメント(0)
-
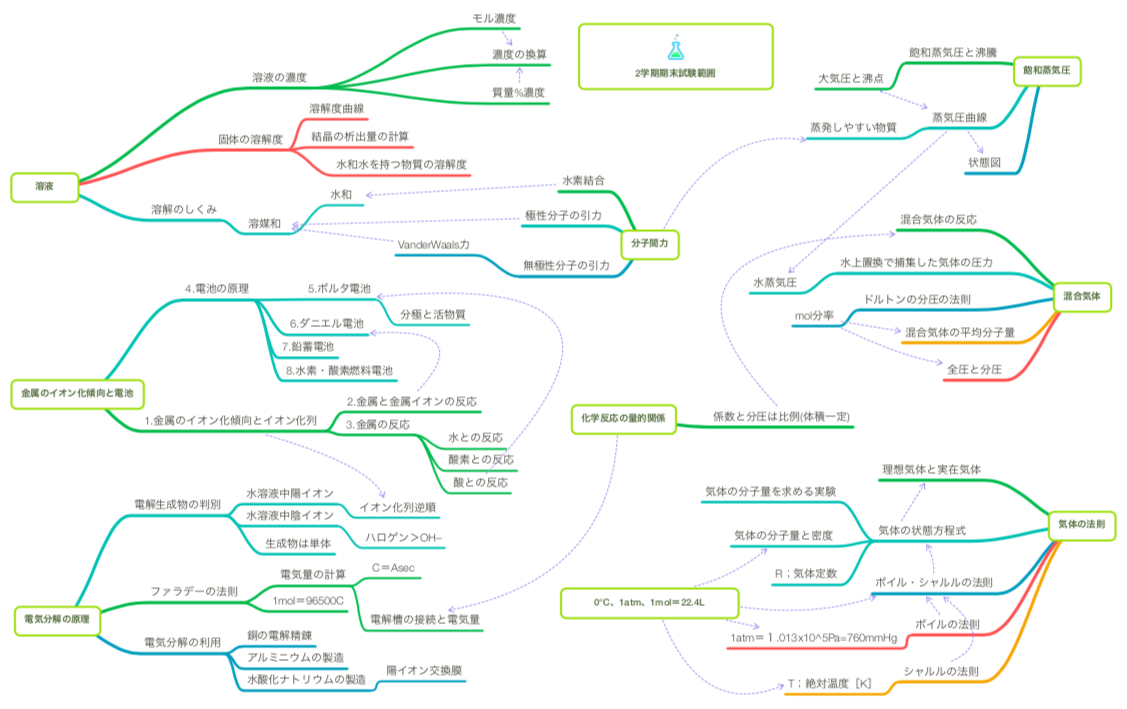
2学期期末試験内容ーマインドマップ風
早いもので、そろそろ期末試験の準備を始める時期になりました。2学期中間試験内容ーmind map風→18/10/3ブログに続いて、期末試験の内容を生徒にアナウンスします。中央が既習事項。左右の2列が試験範囲です。イオン化列・電池・電気分解・状態変化・気体・溶解の仕組み・溶解度と、さすがに時間数の多い2学期後半です。上の図は、「化学の内容を構造的に捉えてほしい」との願いから、各定期試験の前に生徒に配布し説明します。すでに1学期から4枚目になります。これを1年分構造化し関連づける誘惑に捉えられそうになりますが、生徒に全体を示すと「ビビって」やる気なくすのでは…と心配なので、しません。むしろ、全体の構造は生徒自身が作り上げることが大切で、それが勉強になると思います。そのほかに、下のようなプリントを配ります。内容を理解していても、ドリルが大切=力をつけるものと思うので、問題を徹底的にやっておいてもらいたい。「問題やっていて、行き詰まったらMM風マップから関連事項を復習するヒントにしてごらん」と案内します。
2018.11.27
コメント(0)
-

予備実験:気体の状態方程式を使った分子量測定
今年も気体の状態方程式を使った分子量測定実験を行います。昨年の実験とレポートは以下です。PV=nRT→気体の分子量測定⇨2017/11/20ブログPV=nRT→気体の分子量測定の生徒レポート⇨2017/11/22ブログ今年も生徒の実験を検討して、すべての生徒が±3%の誤差で実験できるよう検討し、実験書を変更しました。①試料は四塩化炭素CCl4を使います。その他の揮発性液体を使うことも考えましたが、密度が高く、気体になった時に漏れにくい。気化・液化操作において沸点が適当。分子量が大きいので質量測定の誤差が少なくて済むなど、やはり昨年通りで。(毒性の検討については昨年のブログで見てください)②湯せんにフラスコをつける時、スタンドでフラスコの口を固定して、フラスコ首の部分をできるだけ湯につける。③加熱時間を沸騰状態で15分以上とる。この実験で誤差が増える原因の一つは、液体を完全に気化しないうちに加熱をやめること。④取り外しー冷却する際に、フラスコを傾けないこと。気化した四塩化炭素がこの時にもれる。以上、意識して予備実験しました。結果は以下。昨年の予備実験では−3.25%でしたので、だいぶ改善できたかな。ちなみに、そのほかの気体分子量測定法は以下で検討されています。
2018.11.23
コメント(0)
-

液体窒素の演示実験
2年生「化学基礎」の教科書を終わり、「化学」の内容に入りました。教科書の最初は「物質の三態」です。このところ、実験では操作とデータ処理にかなりシビアな要求をしてきましたので、ちょっと息抜きします。実験室に来てもらって、「液体窒素の実験・低音の世界」で息抜きしてもらいました。Appleのプレゼンソフト、KeyNoteの内容と実験です。低温を測るための温度計の種類です。「目的別に使うよ」とさっと説明。ここでは液体温度計(いわゆるアルコール温度計・水銀温度計)を液体窒素に入れて、凝固してしまい温度が測れないことを示しました。熱電対温度計を用意して、−196℃と表示、ちゃんと教科書に書いていることを確認デュワー瓶の説明し、液体窒素を観察してもらいます。「白い煙は何?」と聞くと「窒素」という答えが大半返ってきます。これは、空気中の水蒸気が冷やされて氷になったものでした。「気体は見えない」んだよ。金属原子の振動を示します。コイルに豆球・電池をつなぎます。室温では抵抗が高いので豆球はつきません。しかし、液体窒素に入れると豆球がほんのりつきます。取り出すと消えてしまいます。金属原子の振動(熱運動)が大きい=温度が高いと、自由電子の移動が邪魔される=抵抗が高い。酸素ボンベから酸素を送り込んで膨らませた風船を試験管に接続。液体窒素で冷やすと液体酸素ができます。この時、風船は縮んで試験管に引き込まれそうになります。この時、質問「体積が約1/800になるのはなぜ?」⇨正解は②ですが、「じゃあ、その飛び回る空間には何があるの?」生徒は「空気」と答えるが、あれこれやり取りのうち「真空」という回答が出てきます。色は淡青色。ネオジム磁石に引きつけられる特徴を見てもらいます。さらに、この中に火のついた線香を入れますが、予想してから実験します。実験結果は③激しく燃えるです。−200℃近くから800℃以上まで、1000℃の温度上昇に耐える試験管はすごいです。火の回りは気体酸素なので、火は消えず激しく反応することを説明しました。今度は二酸化炭素を風船に入れ冷却します。ドライアイスができます。気体から固体ができたのですね。「昇華した」とすぐに生徒から。試験管からドライアイスを取り出したところ。これを、石灰水に入れるとちゃんと濁ります。せっかくなので「状態図」上で、窒素と二酸化炭素の変化の様子を追いかけて、お話はおしまい。あとは、気ー固コロイドのマシュマロを液体窒素で冷やして、(怒られるかもしれんけど)食べてもらいます。「硬さ、冷たさ、味」どの感覚が先に来るか?人の感覚を試してもらいました。さらに、気ー液コロイドのホイップクリームをスプーンですくい液体窒素で冷やし固めて(かりんとみたいになります)シャクシャク食べてもらいます。はるかに温度が高いアイスクリームの方がよっぽど冷たく感じます。これは、とても旨かった。きっと、生徒はマシュマロとホイップクリームしか覚えてないだろう。まあいいか。(注)たくさんの小さな気泡が入っているマシュマロやホイップクリームを液体窒素で固めて食べても、口中に何ら影響はありません。しかし、固体成分が多いチョコレートなどの固体を冷やすと内皮がくっついたり、凍傷になったりして危険です。
2018.11.21
コメント(0)
-
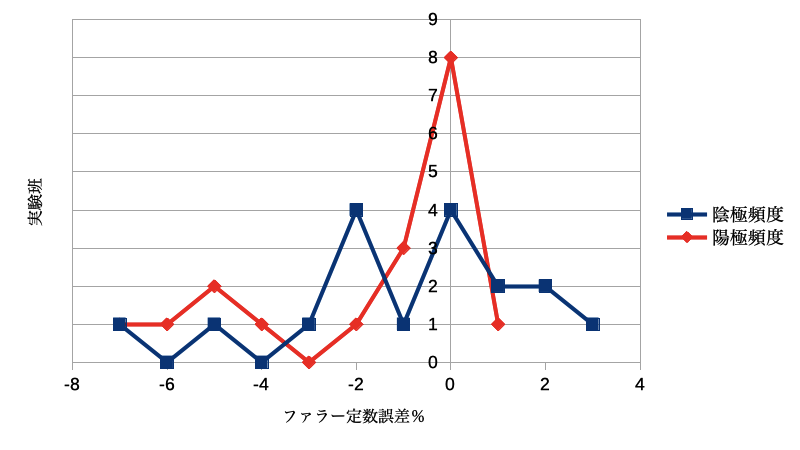
生徒実験「ファラデー定数を検証する」レポートから
生徒実験「ファラデー定数を検証する」⇨11/15ブログの生徒レポートが出ましたので、生徒実験を検証します。生徒実験の精度をヒストグラムにしました。実験は2クラス、計18班が行いました。ファラデー定数96500C/molから、多くの実験班で±2%の範囲に収まっています。特に、陽極のCu板の減少から求めたファラデー定数が良い値を出しています。昨年より、良い精度だったのは、感量1mgの天秤を使い有効数字3桁で実験を行ったことです。(昨年は感量10mgでした)誤差最大の班でも−7%、+3%でした。陰極の偏差が大きいのは、Cuが陰極に析出する際に水を取り込み、それが落としきれない(乾燥が完全にできない)ことが原因であろうと考えています。陽極の偏差がマイナス側に多いのも完全に完走ができていない(=質量が多めに測定sれている)ことが原因だと思います。この生徒実験を精度よく進めるには①電極は事前にサンドペーパーでよく磨かせ、電極間距離を5mm程度に縮める②硫酸銅(Ⅱ)水溶液の濃度を1mol/Lにし、実験開始時に60℃以上に湯煎する(その後放冷)。③電極は4cm以上電解液につけるが、浸ける深さは気をつけなくて良い。④定電流電源で1A〜1.2Aで電気分解する(電流値が少し変動するが、1分ごとの電流値を平均して使う)。班ごとのデータを載せておきます。黄色は誤差が大きかった班です。
2018.11.18
コメント(0)
-

生徒実験「ファラデー定数を検証する」
生徒実験「ファラデー定数を検証する」を実施しました。生徒用テキスト、予備実験については以下の通りです。予備実験「ファラデー定数を求める」 →2018/11/8ブログ生徒用実験箱の中身です。電源関係は木の箱、ビーカー、材料はプラのバットに収めています。定電圧電源は自作、電源アダプターは12V2Aのものです。トータル一班あたり1500円で製作しました。詳しくはこちら電気分解用1500円定電流装置の配線と設定 →2017/9/8ブログさらに、実験操作についての解説板書です。中央の教卓上には、アセトンの入ったビーカー(水切り用)と乾燥ドライヤー、感量1mgの電子天秤を2セット用意しました。有効数字3桁の実験が行えます。実験時間は始業のあいさつー説明ー片付けまでいれてすべての班が終了するまで40分です。残りの時間5分(今日は45分授業)はデータ処理にあてました。実験時、生徒の手際が良くなってきました。一番の効果は、前の時間に「操作についてイメージトレーニングしとけ!」がだいぶ定着してきたからだと思います。レポートは明日提出です。結果は実験班ごとにまとめておしらせします。
2018.11.15
コメント(0)
-

気象観測ロボットを長時間テスト、1週間のデータを取りました
気象観測ロボットをVerUp→10/27ブログで製作した、「気象観測ロボット」を長時間運転テストしています。1週間弱のデータが取れ、安定して動作しています。データはCSVファイルで日毎に記録されていきます。それを表計算ソフト(Apple-numbers)で読み込んでグラフ化しました。雲の画像は記録しないように設定、気圧・温度・湿度のみとりました。温度は室温です。外気温はもっと低いのですが、外に出して測るのが不安でしたので室温を測定しました。
2018.11.13
コメント(0)
-

予備実験「ファラデー定数を求める」
今年も「ファラデー定数を求める」実験を行います。昨年の予備実験↓実験:ファラデー定数を求める→2017.09.08ブログ予備実験を行いました。今年は、できるだけ簡単に行うことを目指してもっとも「手抜き」加熱なし、スターラーなしでやってみます。また、昨年はスペーサーに割り箸1本でしたが2本にしています。(銅板間隔が狭いので生徒がショートさせるミスがありました)テキストは昨年と変えて以下です。乱暴な条件で実験したのですが、約+2.6%の誤差でした。問題は、電流の変動が定電流装置が追いつかないくらい大きいところ昨年は、60度に加熱(以降放冷)スターラーなしで変動幅が0.03Aでしたので、今年は、以下の条件で生徒実験を行おうと思います。①硫酸銅(Ⅱ)溶液をあらかじめ60度程度に加熱する②スターラーは使わない③50mLビーカーに75mLほどの硫酸銅(Ⅱ)溶液を入れる④電解時間は600秒2018/11/09追記電極間隔を割り箸1本分にしましたこちらの方が、陽極の溶け出しが安定していて、実験精度も上がるようです
2018.11.08
コメント(0)
-
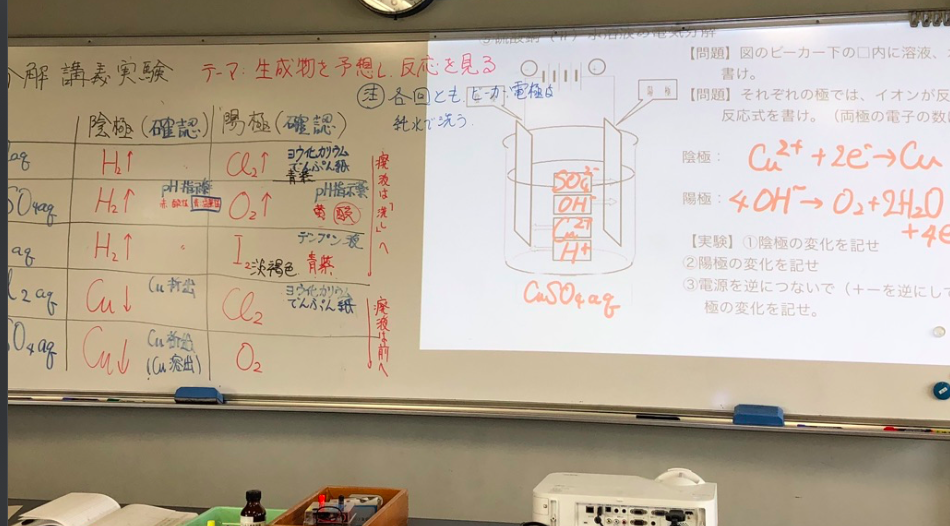
生徒実験「電気分解・講義実験」=様々な水溶液の電解
予備実験「電気分解・講義実験」=様々な水溶液の電解 →11/6ブログにて、準備した「電気分解」の生徒実験を行いました。 電極などの汚れを考えてNaCl,Na2SO4,KI,CuCl2,CuSO4の順に行いました。そのほかに、ヨウ化カリウムでんぷん紙やデンプン溶液、万能pH試験液を用意して、発生する塩素、ヨウ素やpHの変化を観察できるようにしています。 実験は生徒への問いかけ、解説の後、一つずつ行います。一通り実験し、片付けまで48分かかりました。全てを入れたいのでゆっくりはできません。以下は、生徒に記入してもらったプリントテキストです。
2018.11.07
コメント(0)
-

予備実験「電気分解・講義実験」=様々な水溶液の電解
授業は「電池」から「電気分解」へと進んできました。3年生に聞くと「電池」と「電気分解」はわからない、と言います。それは、電池の正極-負極、陽極-陰極の混乱にあると思います。そこで、「電池は全て忘れろ!」と言って、電気分解の授業に入りました。酸化還元を一通り、終えてから思い出してもらいましょう。授業テキストは以下です。授業の基本事項は①水溶液中の全イオンを書き出す②陽イオンは陰極へ、陰イオンは陽極へっ惹かれていく③陽イオンは陰極で電子を受け取る(還元される)④陽イオンの還元される順番はイオン化傾向の小さい順⑤陰イオンはハロゲン>水酸化物イオンの順番で酸化される⑥それぞれのイオンは反応後、単体になる①〜⑥のルールを理解してもらって、あとはルールに従えは反応式を書けますこれを、練習した後、復習しながら講義実験をします。以下、テキストです。先の授業で練習したルールに従って反応式を書いて、実際に実験します。今日はその予備実験をしました。白いバットには電解液。教卓に順に取りにきてもらいます。緑のバットには50mLビーカーx2,ピンセット、炭素棒の電極、万能pH試験液、デンプン液、ヨウ化カリウム-デンプン紙木の箱には2A-12V電源アダプター、定電流電源、バナナチップ-ワニ口クリップを入れてあります。塩化銅(Ⅱ)水溶液の電解です。電圧(赤)と電流(青)が表示されます。定電流電源なので間違えてショートさせても1Aしか流れません。この時、陽極から塩素が出るのがわかりますが、濡らしたヨウ化カリウムでんぷん紙で確認します。硫酸ナトリウム水溶液の電解です。水溶液中にはあらかじめ万能pH試験液を一滴入れておきます。その上で、電解すると陰極(左)が塩基性になるので赤紫色に陽極(右)は酸性になるので橙色になります。こんな感じで実験していくと、操作だけで25分でした。講義実験ですから、復習しながら進めるので、なんとか50分の授業時間に収まりそうです。また、予備実験の結果、銅イオンを含む溶液は後回しにすることにしました。先にやると電極に銅がついて、後の実験の観察の邪魔になるからです。定電流装置は自作です。詳しくはこちら電気分解用1500円定電流装置の配線と設定→2017/9/6ブログ定電流電源装置を一台1500円で作ります→2017/9/5ブログ
2018.11.06
コメント(0)
全12件 (12件中 1-12件目)
1










