この広告は30日以上更新がないブログに表示されております。
新規記事の投稿を行うことで、非表示にすることが可能です。
広告
posted by fanblog
2019年05月21日
4.基底核疾患のメカニズム?B
最終的には、心の働きの脳内メカニス?ムについて述べていきます。
4.基底核疾患のメカニズム?B
4—2;パーキンソン病の治療(ドーパミン補充療法・定位脳手術)
パーキンソン病の治療で重要なものに,ドーパミンの補充療法と定位脳手術がある.
しかし,双方の治療上のコンセプトには根本的な違いがある.
前者は枯渇したドーパミンを補うことで基底核の機能を回復させることが主眼である.
後者は,基底核内の異常活動をinterventionし,過剰な基底核出力を低減させるのが目的である.
例えば,視床下核や淡蒼球内節の過剰な活動をブロックすれば,大脳皮質や脳幹の活動は回復し,
大脳皮質や脳幹のニューロンは正常の活動を取り戻すことができる.
しかし,基底核の活動を正常な状態に戻すことを目指してはいない.
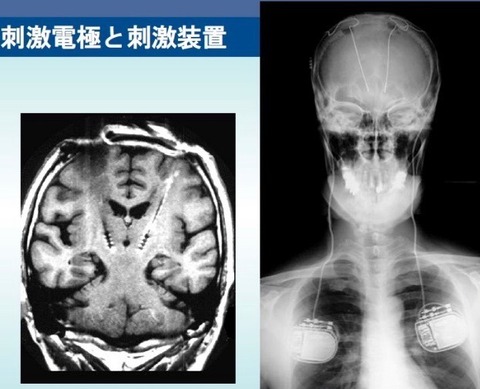
楢林博士が用いた定位脳手術は、振戦に同期して発射する視床Vim核ニューロンを同定後,
直径2〜3mmの電気凝固巣を作成することにより(Thalamotomy)、振戦は消失しスムーズに円を描くことが出来るようになった[49].
近年,脳深部刺激法(Deep brain stimulation;DBS)が盛んに施行されている.
視床下核に50Hz〜200Hzの連続電気刺激を加え,
亢進しているニューロン活動をブロックするのがこの治療の目的である[50].
刺激頻度の増加に伴い,手の振るえは消失し,円を大きく,それもスムーズに描くことができる様になった[51].
前世紀の末よりドーパミン産生細胞の線条体内への移植治療[52]や
ドーパミンニューロンの保護[53]を視野に入れた新たな治療手法も考案されている.
その一方で,パーキンソン病の全ゲノムスクリーニングが終了し,
この疾患の発症には複数遺伝子が関与する証拠も提示された[54].
この疾患に対する遺伝子治療や,個々の患者の遺伝子型に合わせたオーダーメード治療も可能になる日が近いのかも知れない.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座 高草木 薫
参考文献
49.楢林博太郎:パーキンソン病の研究を顧みて.In:錐体外路系への歩み.創造出版,pp 101— 109, 2001.
50.Marsden CD & Obeso JA : The function of the basal ganglia and the paradox of stereotaxic surgery in
Parkinson’s disease. Brain 117 : 877— 897, 1994.
51.谷口 真:脳深部刺激療法の現状.In:Parkinson病をめぐって.Clinical Neurosci 19 : 701— 703, 2001.
52.Studer L, Tabar, V & McKay RDG, 1998. Transplantation of expanded mesencephalic precursors leads to
recovery in parkinsonian rats. Nat Neurosci 1, 290—295, 1998.
53.Dawson TM & Dawson VL : Neuroprotective and neurorestorative strategies for Parkinson’s disease.
Nat Neurosci 5 : 1058— 1061, 2002.
54.Scott WK, Nance MA, Watts RL, Hubble JP, Koller WC, Lyons K, Pahwa R, Stern MB, Colcher A, Hiner
BC, Jankovic J, Ondo WG, Allen FH Jr, Goetz CG, Small GW, Masterman D, Mastaglia F, Laing NG, Stajich JM, Slotterbeck B, Booze MW, Ribble RC, Rampersaud E, West SG, Gibson RA, Middleton LT, Roses AD, Haines JL, Scott BL, Vance JM & Pericak-Vance MA : Complete genomic screen in Parkinson disease. JAMA 286 : 2239— 2244, 2001.
4.基底核疾患のメカニズム?B
4—2;パーキンソン病の治療(ドーパミン補充療法・定位脳手術)
パーキンソン病の治療で重要なものに,ドーパミンの補充療法と定位脳手術がある.
しかし,双方の治療上のコンセプトには根本的な違いがある.
前者は枯渇したドーパミンを補うことで基底核の機能を回復させることが主眼である.
後者は,基底核内の異常活動をinterventionし,過剰な基底核出力を低減させるのが目的である.
例えば,視床下核や淡蒼球内節の過剰な活動をブロックすれば,大脳皮質や脳幹の活動は回復し,
大脳皮質や脳幹のニューロンは正常の活動を取り戻すことができる.
しかし,基底核の活動を正常な状態に戻すことを目指してはいない.

楢林博士が用いた定位脳手術は、振戦に同期して発射する視床Vim核ニューロンを同定後,
直径2〜3mmの電気凝固巣を作成することにより(Thalamotomy)、振戦は消失しスムーズに円を描くことが出来るようになった[49].
近年,脳深部刺激法(Deep brain stimulation;DBS)が盛んに施行されている.
視床下核に50Hz〜200Hzの連続電気刺激を加え,
亢進しているニューロン活動をブロックするのがこの治療の目的である[50].
刺激頻度の増加に伴い,手の振るえは消失し,円を大きく,それもスムーズに描くことができる様になった[51].
前世紀の末よりドーパミン産生細胞の線条体内への移植治療[52]や
ドーパミンニューロンの保護[53]を視野に入れた新たな治療手法も考案されている.
その一方で,パーキンソン病の全ゲノムスクリーニングが終了し,
この疾患の発症には複数遺伝子が関与する証拠も提示された[54].
この疾患に対する遺伝子治療や,個々の患者の遺伝子型に合わせたオーダーメード治療も可能になる日が近いのかも知れない.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座 高草木 薫
参考文献
49.楢林博太郎:パーキンソン病の研究を顧みて.In:錐体外路系への歩み.創造出版,pp 101— 109, 2001.
50.Marsden CD & Obeso JA : The function of the basal ganglia and the paradox of stereotaxic surgery in
Parkinson’s disease. Brain 117 : 877— 897, 1994.
51.谷口 真:脳深部刺激療法の現状.In:Parkinson病をめぐって.Clinical Neurosci 19 : 701— 703, 2001.
52.Studer L, Tabar, V & McKay RDG, 1998. Transplantation of expanded mesencephalic precursors leads to
recovery in parkinsonian rats. Nat Neurosci 1, 290—295, 1998.
53.Dawson TM & Dawson VL : Neuroprotective and neurorestorative strategies for Parkinson’s disease.
Nat Neurosci 5 : 1058— 1061, 2002.
54.Scott WK, Nance MA, Watts RL, Hubble JP, Koller WC, Lyons K, Pahwa R, Stern MB, Colcher A, Hiner
BC, Jankovic J, Ondo WG, Allen FH Jr, Goetz CG, Small GW, Masterman D, Mastaglia F, Laing NG, Stajich JM, Slotterbeck B, Booze MW, Ribble RC, Rampersaud E, West SG, Gibson RA, Middleton LT, Roses AD, Haines JL, Scott BL, Vance JM & Pericak-Vance MA : Complete genomic screen in Parkinson disease. JAMA 286 : 2239— 2244, 2001.
2019年05月20日
4.基底核疾患のメカニズム?A
最終的には、心の働きの脳内メカニス?ムについて述べていきます。
4.基底核疾患のメカニズム?A
4—1;パーキンソン病
(3)筋固縮(Muscular rigidity)
パーキンソン病の筋固縮は,
他動的に関節を屈曲伸展させると鉛様の抵抗があるため鉛様固縮(Lead pipe rigidity)であるとか,
歯車を回す際のガタガタという抵抗を生じることから歯車様固縮(Cogwheel rigidity)などと表現される.
α運動細胞の活動亢進[41]や
静的γ運動細胞の興奮性増加に伴う緊張性伸張反射の亢進[42]により
筋固縮が誘発される.
α運動細胞やγ運動細胞の興奮性の異常は,
先に記述した筋緊張抑制系と促通系のアンバランスにより誘発される.
筋緊張の抑制には抑制性Ib介在細胞が関与する[19].
パーキンソン病では抑制性Ib介在細胞の活動が低下しており,
これにより運動細胞の興奮性は増加して,筋緊張が亢進している可能性がある[43].
(4)姿勢反射障害(Postural disturbances)

パーキンソン病では体幹筋の運動も障害されて,
特徴的な姿勢異常と姿勢反射障害が出現する.
また立ち直り反射が強く障害される.
前方から前胸部を押すと後方に転倒し易くなり,後方突進現象が出現することもある.
病状が進行すると,その場で丸太のように転倒することもある.
体幹筋の機能障害により寝返りも困難となる.
これは姿勢反射障害と相まって,
この疾患の長期経過で日常生活上の困難をきたす最大の要因となる.
姿勢反射の基本的な神経機構は脳幹に存在するので,
運動系ループと基底核—脳幹系の異常が姿勢反射障害に関与すると思われる.
進行したパーキンソン病では脳幹網様体のニューロンも変性する[44]ため,
これが姿勢反射障害に直接関与している可能性もある.
(5)高次脳機能や精神機能の障害
パーキンソン病では,認知機能,手続き記憶,学習などの高次脳機能障害[45]や,
思考の遅延や抑うつ傾向,幻覚などの精神症状も出現する[46].
病状が進行すると知能障害も出現する[47].
高次脳機能障害や精神障害には,
大脳皮質─基底核ループの障害に加えて,ドーパミン欠乏そのものが関与する.
病状の進行に伴って腹側被蓋野のドーパミン細胞も変性・脱落するため,
前頭前野や辺縁系の機能も低下する.
進行したパーキンソン病では,
脳幹内のコリン作動系(脚橋被蓋核),
ノルアドレナリン作動系(青斑核),
セロトニン作動系(縫線核)のニューロンも脱落する[44].
その結果,不眠やレム睡眠の減少,
レム睡眠時異常行動症候群(REM behavioral disorders;RBD)などの
睡眠障害が誘発されると考えられている[48].
神経伝達物質の低下は覚醒レベルの低下や抑うつ状態,周囲に対する関心や注意機能も低下させる.
外界からの情報取得や大脳皮質連合野における情報処理過程の障害も,
この疾患における高次脳機能障害や精神機能障害の背景に存在し,
皮質下痴呆あるいは偽痴呆と呼ばれる状態を誘発すると推測される.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
19.Takakusaki K, Kohyama J, Matsuyama K & Mori S : Medullary reticulospinal tract mediation of generalized motor inhibition in cats : Parallel inhibitory mechanisms acting on motoneurons and on interneuronal transmission in reflex pathways. Neurosci 103, 511— 527, 2001.
41.Marsden CD : The mysterious motor function of the basal ganglia : The Robert Wartenberg Lecture. Neurology 32 : 514— 539, 1982.
42.Shimazu H, Hongo T & Kubota K : Two types of central influences on gamma motor system. J Neuro
physiol 25, 309— 323, 1962.
43.Delwaide PJ, Pepin JL & Maertens de Noordhout A : Short latency autogenic inhibition in patient with
parkinsonian rigidity. Ann Neurol 30 : 83— 89, 1991.
44.水谷俊雄:病理形態.In:Parkinson病-update.Clinical Neurosci 12 : 1002— 1005, 1994.
45.Graybiel AM : Building action repertoires : memory and learning functions of the basal ganglia. Curr Opin
Neurobiol 5 : 733— 741, 1995.
46.Mellers JD, Quinn NP & Ron MA : Psychotic and depressive symptoms in Parkinson’s disease. A study of
the growth hormone response to apomorphine. Br J Psychiatry 167 : 522— 526, 1995.
47.Giladi N, Treves TA, Paleacu D, Shabtai H, Orlov Y, Kandinov B, Simon ES & Korczyn AD : Risk factor
for dementia, depression and psychosis in longstanding Parkinson’s disease. J Neural Transm 107 : 59— 71,
2000.
48.Arnulf I, Bonnet AM, Damier P, Bejjani BP, Seilhean D, Derenne JP & Agid Y : Hallucinations, REM sleep,
and Parkinson’s disease : a medical hypothesis. Neurology 55 : 281— 288, 2000.
4.基底核疾患のメカニズム?A
4—1;パーキンソン病
(3)筋固縮(Muscular rigidity)
パーキンソン病の筋固縮は,
他動的に関節を屈曲伸展させると鉛様の抵抗があるため鉛様固縮(Lead pipe rigidity)であるとか,
歯車を回す際のガタガタという抵抗を生じることから歯車様固縮(Cogwheel rigidity)などと表現される.
α運動細胞の活動亢進[41]や
静的γ運動細胞の興奮性増加に伴う緊張性伸張反射の亢進[42]により
筋固縮が誘発される.
α運動細胞やγ運動細胞の興奮性の異常は,
先に記述した筋緊張抑制系と促通系のアンバランスにより誘発される.
筋緊張の抑制には抑制性Ib介在細胞が関与する[19].
パーキンソン病では抑制性Ib介在細胞の活動が低下しており,
これにより運動細胞の興奮性は増加して,筋緊張が亢進している可能性がある[43].
(4)姿勢反射障害(Postural disturbances)

パーキンソン病では体幹筋の運動も障害されて,
特徴的な姿勢異常と姿勢反射障害が出現する.
また立ち直り反射が強く障害される.
前方から前胸部を押すと後方に転倒し易くなり,後方突進現象が出現することもある.
病状が進行すると,その場で丸太のように転倒することもある.
体幹筋の機能障害により寝返りも困難となる.
これは姿勢反射障害と相まって,
この疾患の長期経過で日常生活上の困難をきたす最大の要因となる.
姿勢反射の基本的な神経機構は脳幹に存在するので,
運動系ループと基底核—脳幹系の異常が姿勢反射障害に関与すると思われる.
進行したパーキンソン病では脳幹網様体のニューロンも変性する[44]ため,
これが姿勢反射障害に直接関与している可能性もある.
(5)高次脳機能や精神機能の障害
パーキンソン病では,認知機能,手続き記憶,学習などの高次脳機能障害[45]や,
思考の遅延や抑うつ傾向,幻覚などの精神症状も出現する[46].
病状が進行すると知能障害も出現する[47].
高次脳機能障害や精神障害には,
大脳皮質─基底核ループの障害に加えて,ドーパミン欠乏そのものが関与する.
病状の進行に伴って腹側被蓋野のドーパミン細胞も変性・脱落するため,
前頭前野や辺縁系の機能も低下する.
進行したパーキンソン病では,
脳幹内のコリン作動系(脚橋被蓋核),
ノルアドレナリン作動系(青斑核),
セロトニン作動系(縫線核)のニューロンも脱落する[44].
その結果,不眠やレム睡眠の減少,
レム睡眠時異常行動症候群(REM behavioral disorders;RBD)などの
睡眠障害が誘発されると考えられている[48].
神経伝達物質の低下は覚醒レベルの低下や抑うつ状態,周囲に対する関心や注意機能も低下させる.
外界からの情報取得や大脳皮質連合野における情報処理過程の障害も,
この疾患における高次脳機能障害や精神機能障害の背景に存在し,
皮質下痴呆あるいは偽痴呆と呼ばれる状態を誘発すると推測される.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
19.Takakusaki K, Kohyama J, Matsuyama K & Mori S : Medullary reticulospinal tract mediation of generalized motor inhibition in cats : Parallel inhibitory mechanisms acting on motoneurons and on interneuronal transmission in reflex pathways. Neurosci 103, 511— 527, 2001.
41.Marsden CD : The mysterious motor function of the basal ganglia : The Robert Wartenberg Lecture. Neurology 32 : 514— 539, 1982.
42.Shimazu H, Hongo T & Kubota K : Two types of central influences on gamma motor system. J Neuro
physiol 25, 309— 323, 1962.
43.Delwaide PJ, Pepin JL & Maertens de Noordhout A : Short latency autogenic inhibition in patient with
parkinsonian rigidity. Ann Neurol 30 : 83— 89, 1991.
44.水谷俊雄:病理形態.In:Parkinson病-update.Clinical Neurosci 12 : 1002— 1005, 1994.
45.Graybiel AM : Building action repertoires : memory and learning functions of the basal ganglia. Curr Opin
Neurobiol 5 : 733— 741, 1995.
46.Mellers JD, Quinn NP & Ron MA : Psychotic and depressive symptoms in Parkinson’s disease. A study of
the growth hormone response to apomorphine. Br J Psychiatry 167 : 522— 526, 1995.
47.Giladi N, Treves TA, Paleacu D, Shabtai H, Orlov Y, Kandinov B, Simon ES & Korczyn AD : Risk factor
for dementia, depression and psychosis in longstanding Parkinson’s disease. J Neural Transm 107 : 59— 71,
2000.
48.Arnulf I, Bonnet AM, Damier P, Bejjani BP, Seilhean D, Derenne JP & Agid Y : Hallucinations, REM sleep,
and Parkinson’s disease : a medical hypothesis. Neurology 55 : 281— 288, 2000.
2019年05月19日
4.基底核疾患のメカニズム?@
最終的には、心の働きの脳内メカニス?ムについて述べていきます。
4.基底核疾患のメカニズム?@
基底核疾患は筋緊張亢進・運動減少症Hypertonus-Hypokinetic syndromes(パーキンソン病)
と筋緊張低下・運動増加症Hypotonus-Hyperkinetic syndromes(ハンチントン舞踏病やバリス
ムス)に大別される.
これまでの説明をもとに,
主にパーキンソン病の病態を考察してみよう.
4—1;パーキンソン病
パーキンソン病では,黒質緻密部のドーパミンニューロンが変性・脱落する.
線条体におけるドーパミンの減少は,
直接路の活動低下と
間接路の亢進を誘発し,
基底核からのGABA作
動性出力が増加する[14, 16, 34].
その結果,次に示す様々な運動機能障害や,認知,学習などの高次脳機能,
さらに精神活動や睡眠の障害などが誘発されると考えられる[35].
(1)安静時振戦(Resting tremor)
振戦は4〜6Hzの周波数で安静時に出現することが多い.
手指の振戦は丸薬を丸める動作に似ておりPill rollingと呼ばれる.
振戦に同期して発射するニューロンが
パーキンソン病患者の視床Vim核やパーキンソン病モデル動物の淡蒼球,視床下核で記録されている[36, 37].
ドーパミン減少に伴う基底核内神経回路の活動異常が視床下核と淡蒼球外節での発振現象を誘発し,
その出力が視床—大脳投射系〜皮質脊髄路系や脳幹からの下行路を介して手足の振るえを誘発するのであろ
う.
(2)無動(Akinesia)
無動症はパーキンソン病に見られる随意運動障害の総称として使用される傾向がある.
類語に寡動(Hypokinesia)や動作緩慢(Bradykinesia)がある.
これらは基底核からの抑制出力の亢進により
運動系ループの活動が低下するために誘発される.
動作の開始困難(無動)と動作緩慢は,各々運動準備と運動遂行に関連するサブループの異常により誘発される可能性がある.
前頭前野ループや辺縁系ループの活動低下に伴う意思発動の減少や抑うつ傾向も無動症の一要因である.
仮面様顔貌Mask-like faceや小字症Micrographiaも無動を反映する症状と考えられている.
パーキンソン病では,すくみ足,小刻歩行,歩行速度の減少,歩幅の減少などの歩行障害が高率に出現する[38, 39].
一方,床に横縞模様をつけると患者はスムーズに歩くことができる.
これを逆説性歩行(Kinesie Paradoxale)と呼び,その際外側運動前野の血流が有意に増加することがわ
かった[40].
即ち,歩行障害には運動プログラミングの異常があり,特定の視覚入力が外側運動前野を賦活することにより歩行のプログラムが駆動されて歩き易くなると推測される.
また,ネコを用いた研究により,黒質網様部から歩行誘発領域への抑制出力の増加により,
歩行開始の遅延,歩行速度の減少,歩幅の減少などパーキンソン病と類似する歩行パターンが誘発された[18].
従って歩行障害は,大脳皮質─基底核ループと基底核─脳幹系の双方の異常により誘発されると考え
られる.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
14.高草木薫,斉藤和也,幅口竜也 & 杉本純子:大脳基底核による歩行と筋緊張の制御.脳の科学 23 ; 1049
— 1054, 2001.
16.Delong MR : The basal ganglia. In : Principles of neural science, 4th edition, Ed. Kandel ER, Schwartz JH
& Jessell TM, McGraw-Hill Press, Heath Professions Division pp 853-867, 2000.
18.Takakusaki K, Habaguchi T, Ohtinata-Sugimoto J,
Saitoh K & Sakamoto T : Basal ganglia efferents to the brainstem centers controlling postural muscle tone and locomotion ; A new concept for understanding motor disorders in basal ganglia dysfunction. Neurosci : in press.
34.Wichmann T & Delong MR : Functional and pathological models of the basal ganglia Curr Opin Neurobiol 6 : 751— 758, 1996.
35.Brooks DJ : The role of the basal ganglia in motor control : contribution from PET. J Neurol Sci 128 : 1—
13, 1995.
36.Raz A, Vaadia E & Bergman H : Firing patterns and correlations of spontaneous discharge of pallidal neurons in the normal and tremulous 1-methyl-4-phenyl1,2,3,6-tetrahydropyrine vervet model of parkinsonism. J Neurosci 20 : 8859— 8871, 2000.
37.Bergman H, Wichmann T, Karmon B & Delong MR : The primate subthalamic nucleus. II. Neuronal activity in the MPTP model of parkinsonism. J Neurophysiol 72 : 507— 520, 1994.
38.Morris ME, Iansek R, Matyas TA & Summers J : The pathogenesis of gait hypokinesia in Parkinson’s disease. Brain 117 : 1169— 1181, 1994.
39.Pahapill PA & Lozano AM : The pedunculopontine nucleus and Parkinson’s disease. Brain 123 : 1767 —
1783, 2000.
40.Hanakawa T, Katsumi Y, Fukuyama H, Honda M, Hayashi T, Kimura J & Shibasaki H : Mechanisms of
underlying gait disturbance in Parkinson’s disease : a single photon emission computed tomography study.
Bain 122 : 1271— 1281, 1999.
4.基底核疾患のメカニズム?@
基底核疾患は筋緊張亢進・運動減少症Hypertonus-Hypokinetic syndromes(パーキンソン病)
と筋緊張低下・運動増加症Hypotonus-Hyperkinetic syndromes(ハンチントン舞踏病やバリス
ムス)に大別される.
これまでの説明をもとに,
主にパーキンソン病の病態を考察してみよう.
4—1;パーキンソン病
パーキンソン病では,黒質緻密部のドーパミンニューロンが変性・脱落する.

線条体におけるドーパミンの減少は,
直接路の活動低下と
間接路の亢進を誘発し,
基底核からのGABA作
動性出力が増加する[14, 16, 34].
その結果,次に示す様々な運動機能障害や,認知,学習などの高次脳機能,
さらに精神活動や睡眠の障害などが誘発されると考えられる[35].
(1)安静時振戦(Resting tremor)
振戦は4〜6Hzの周波数で安静時に出現することが多い.
手指の振戦は丸薬を丸める動作に似ておりPill rollingと呼ばれる.
振戦に同期して発射するニューロンが
パーキンソン病患者の視床Vim核やパーキンソン病モデル動物の淡蒼球,視床下核で記録されている[36, 37].
ドーパミン減少に伴う基底核内神経回路の活動異常が視床下核と淡蒼球外節での発振現象を誘発し,
その出力が視床—大脳投射系〜皮質脊髄路系や脳幹からの下行路を介して手足の振るえを誘発するのであろ
う.
(2)無動(Akinesia)
無動症はパーキンソン病に見られる随意運動障害の総称として使用される傾向がある.
類語に寡動(Hypokinesia)や動作緩慢(Bradykinesia)がある.
これらは基底核からの抑制出力の亢進により
運動系ループの活動が低下するために誘発される.
動作の開始困難(無動)と動作緩慢は,各々運動準備と運動遂行に関連するサブループの異常により誘発される可能性がある.
前頭前野ループや辺縁系ループの活動低下に伴う意思発動の減少や抑うつ傾向も無動症の一要因である.
仮面様顔貌Mask-like faceや小字症Micrographiaも無動を反映する症状と考えられている.
パーキンソン病では,すくみ足,小刻歩行,歩行速度の減少,歩幅の減少などの歩行障害が高率に出現する[38, 39].
一方,床に横縞模様をつけると患者はスムーズに歩くことができる.
これを逆説性歩行(Kinesie Paradoxale)と呼び,その際外側運動前野の血流が有意に増加することがわ
かった[40].
即ち,歩行障害には運動プログラミングの異常があり,特定の視覚入力が外側運動前野を賦活することにより歩行のプログラムが駆動されて歩き易くなると推測される.
また,ネコを用いた研究により,黒質網様部から歩行誘発領域への抑制出力の増加により,
歩行開始の遅延,歩行速度の減少,歩幅の減少などパーキンソン病と類似する歩行パターンが誘発された[18].
従って歩行障害は,大脳皮質─基底核ループと基底核─脳幹系の双方の異常により誘発されると考え
られる.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
14.高草木薫,斉藤和也,幅口竜也 & 杉本純子:大脳基底核による歩行と筋緊張の制御.脳の科学 23 ; 1049
— 1054, 2001.
16.Delong MR : The basal ganglia. In : Principles of neural science, 4th edition, Ed. Kandel ER, Schwartz JH
& Jessell TM, McGraw-Hill Press, Heath Professions Division pp 853-867, 2000.
18.Takakusaki K, Habaguchi T, Ohtinata-Sugimoto J,
Saitoh K & Sakamoto T : Basal ganglia efferents to the brainstem centers controlling postural muscle tone and locomotion ; A new concept for understanding motor disorders in basal ganglia dysfunction. Neurosci : in press.
34.Wichmann T & Delong MR : Functional and pathological models of the basal ganglia Curr Opin Neurobiol 6 : 751— 758, 1996.
35.Brooks DJ : The role of the basal ganglia in motor control : contribution from PET. J Neurol Sci 128 : 1—
13, 1995.
36.Raz A, Vaadia E & Bergman H : Firing patterns and correlations of spontaneous discharge of pallidal neurons in the normal and tremulous 1-methyl-4-phenyl1,2,3,6-tetrahydropyrine vervet model of parkinsonism. J Neurosci 20 : 8859— 8871, 2000.
37.Bergman H, Wichmann T, Karmon B & Delong MR : The primate subthalamic nucleus. II. Neuronal activity in the MPTP model of parkinsonism. J Neurophysiol 72 : 507— 520, 1994.
38.Morris ME, Iansek R, Matyas TA & Summers J : The pathogenesis of gait hypokinesia in Parkinson’s disease. Brain 117 : 1169— 1181, 1994.
39.Pahapill PA & Lozano AM : The pedunculopontine nucleus and Parkinson’s disease. Brain 123 : 1767 —
1783, 2000.
40.Hanakawa T, Katsumi Y, Fukuyama H, Honda M, Hayashi T, Kimura J & Shibasaki H : Mechanisms of
underlying gait disturbance in Parkinson’s disease : a single photon emission computed tomography study.
Bain 122 : 1271— 1281, 1999.
2019年05月18日
3.基底核の入出力と神経回路の機能?C
最終的には、心の働きの脳内メカニス?ムについて述べていきます。
3.基底核の入出力と神経回路の機能?C
3—5;ドーパミン作動系
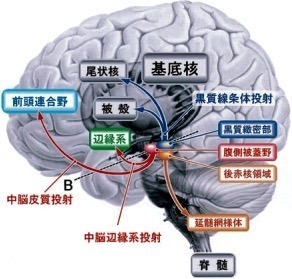
中脳ドーパミン作動性ニューロンは,
黒質緻密部,腹側被蓋野,後赤核領域に存在する.
黒質緻密部からは被殻や尾状核に(黒質線条体投射),
腹側被蓋野からは前頭連合野(中脳皮質投射)や側座核,辺縁系(中脳辺縁系投射)に[28],
後赤核領域からは延髄網様体に投射がある[29].
(1)ドーパミンによる基底核神経回路の調節
ドーパミンは直接路と間接路の起始ニューロンに対して反対の作用を持つ[30].
運動系ループを例にとると,
ドーパミンにより直接路は活動し,
間接路は抑制されるため基底核の出力は低下するので運動は増加する.
一方,ドーパミンが減少すると直接路の活動は低下し,
間接路の活動は亢進する.
その結果,基底核の出力は増加し,運動は減少する.
従ってドーパミンレベルの変化により,
視床─大脳投射系や脳幹のニューロン群の興奮性は強く修飾される.
(2)ドーパミンと高次脳機能
中脳ドーパミン作動系は中脳皮質投射や中脳辺縁系投射,
そして黒質線条体投射を介して,
各領域のニューロン活動を修飾し,
我々の行動パフォーマンスに大きな影響を及ぼす.
特に,報酬が最大になるような行動や思考の文脈性の形成に
ドーパミンが強く関与すると考えられる[31](強化学習).
我々が特定の環境の中で最も適切なStrategyを学習し[32](順序手続き学習),
新たな環境を創造する上でドーパミンは重要な役割を演じている.
統合失調症(精神分裂病)では,中脳皮質投射の活動は低下し,
中脳辺縁系投射の活動は亢進する.
前者は前頭葉の機能低下をもたらし,
後者は辺縁系に作用して幻覚や妄想などを誘発する.
この疾患の治療にはドーパミン阻害剤を用いるため
パーキンソン病様の症状が出現することがある.
ドーパミンは運動機能のみならず精神機能にも多大な影響をもたらしている.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
28.Kandel ER : Disorders of thought and volition : Schizophrenia. In : Principles of neural science, 4th edition,
Ed. Kandel ER, Schwartz JH & Jessell TM, McGrawHill Press, Heath Professions Division pp 1188— 1208,
2000.
29.Von Krosigk M, Smith Y, Bolam JP & Smith D : Synaptic organization of GABAergic inputs from the
striatum and the globus pallidus onto neurons in the substantia nigra and retrorubral field which project
to the medullary reticular formation. Neurosci 50 : 531— 549, 1992.
30.Gerfen CR, Engber TM, Mahan LC, Susel Z, Chase TN, Monsma FJ Jr, & Sibley DR : D1 and D2
dopamine receptor-regulated gene expression of striatonigral and striatopallidal neurons. Science 250 :
1429— 1432, 1990.
31.Schultz W : Predictive reward signal of dopamine neurons. J Neurophysiol, 80 : 1— 27, 1998.
32.Hikosaka O, Nakahara H, Rand MK, Sakai K, Lu X, Nakamura K, Miyachi S & Doya K : Parallel neural networks for learning sequential procedures. Trends
Neurosci 22 : 464— 471, 1999.
3.基底核の入出力と神経回路の機能?C
3—5;ドーパミン作動系

中脳ドーパミン作動性ニューロンは,
黒質緻密部,腹側被蓋野,後赤核領域に存在する.
黒質緻密部からは被殻や尾状核に(黒質線条体投射),
腹側被蓋野からは前頭連合野(中脳皮質投射)や側座核,辺縁系(中脳辺縁系投射)に[28],
後赤核領域からは延髄網様体に投射がある[29].
(1)ドーパミンによる基底核神経回路の調節
ドーパミンは直接路と間接路の起始ニューロンに対して反対の作用を持つ[30].
運動系ループを例にとると,
ドーパミンにより直接路は活動し,
間接路は抑制されるため基底核の出力は低下するので運動は増加する.
一方,ドーパミンが減少すると直接路の活動は低下し,
間接路の活動は亢進する.
その結果,基底核の出力は増加し,運動は減少する.
従ってドーパミンレベルの変化により,
視床─大脳投射系や脳幹のニューロン群の興奮性は強く修飾される.
(2)ドーパミンと高次脳機能
中脳ドーパミン作動系は中脳皮質投射や中脳辺縁系投射,
そして黒質線条体投射を介して,
各領域のニューロン活動を修飾し,
我々の行動パフォーマンスに大きな影響を及ぼす.
特に,報酬が最大になるような行動や思考の文脈性の形成に
ドーパミンが強く関与すると考えられる[31](強化学習).
我々が特定の環境の中で最も適切なStrategyを学習し[32](順序手続き学習),
新たな環境を創造する上でドーパミンは重要な役割を演じている.
統合失調症(精神分裂病)では,中脳皮質投射の活動は低下し,
中脳辺縁系投射の活動は亢進する.
前者は前頭葉の機能低下をもたらし,
後者は辺縁系に作用して幻覚や妄想などを誘発する.
この疾患の治療にはドーパミン阻害剤を用いるため
パーキンソン病様の症状が出現することがある.
ドーパミンは運動機能のみならず精神機能にも多大な影響をもたらしている.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
28.Kandel ER : Disorders of thought and volition : Schizophrenia. In : Principles of neural science, 4th edition,
Ed. Kandel ER, Schwartz JH & Jessell TM, McGrawHill Press, Heath Professions Division pp 1188— 1208,
2000.
29.Von Krosigk M, Smith Y, Bolam JP & Smith D : Synaptic organization of GABAergic inputs from the
striatum and the globus pallidus onto neurons in the substantia nigra and retrorubral field which project
to the medullary reticular formation. Neurosci 50 : 531— 549, 1992.
30.Gerfen CR, Engber TM, Mahan LC, Susel Z, Chase TN, Monsma FJ Jr, & Sibley DR : D1 and D2
dopamine receptor-regulated gene expression of striatonigral and striatopallidal neurons. Science 250 :
1429— 1432, 1990.
31.Schultz W : Predictive reward signal of dopamine neurons. J Neurophysiol, 80 : 1— 27, 1998.
32.Hikosaka O, Nakahara H, Rand MK, Sakai K, Lu X, Nakamura K, Miyachi S & Doya K : Parallel neural networks for learning sequential procedures. Trends
Neurosci 22 : 464— 471, 1999.
2019年05月17日
3.基底核の入出力と神経回路の機能?B
3.基底核の入出力と神経回路の機能?B
3—4;大脳基底核内の神経回路
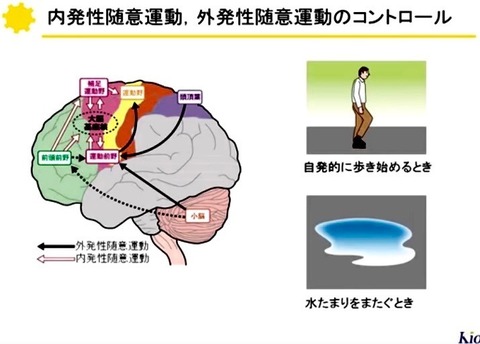

大脳皮質から受け取った情報は,
基底核内の神経回路によりどの様に修飾されて出力されるのだろうか?
基底核の中で
視床下核ニューロンがグルタミン酸作動性,
黒質緻密部ニューロンがドーパミン作動性である以外は
全てGABA作動性(抑制性)である.
出力核である淡蒼球内節や黒質網様部のGABA作動性ニューロンは数10〜200Hzで発射しており[24, 25],
その発射頻度は次の3経路により調節されている.
?@ハイパー直接路(Hyper-direct pathway);
大脳皮質から興奮性入力を受ける視床下核ニューロンが,
出力核のGABA作動性ニューロンに単シナプス性に投射する経路.
この経路は最も短時間で出力ニューロンに到達し,その発射頻度を増加させるため
基底核の抑制性出力は亢進する.
?A直接路(Direct pathway);
GABAとサブスタンスPを持つ線条体ニューロンが出力核に単シナプス性に投射する経路.
ドーパミンはD1受容体を介してこの線条体ニューロン群を興奮させるため直接路の活動は亢進する.
その結果,基底核の抑制性出力は減少する.
?B間接路(Indirect pathway);
GABAとエンケファリンを持つ線条体ニューロンが
多シナプス性に淡蒼球外節のGABA作動性ニューロンと
視床下核のグルタミン酸作動性ニューロンを介して出力核に投射する経路.
この経路が働くと基底核の出力は増加する.
ドーパミンはD2受容体を介してこれらの細胞を抑制するので間接路の活動は低下し,
基底核の出力は減少する.
それでは,これらの3経路はどの様な仕組みで基底核からの出力をコントロールするのであろうか.
大脳皮質からの信号はまずハイパー直接路を興奮させ,
視床—大脳皮質投射ニューロンや脳幹ニューロンを広く抑制する(a).
次に直接路を経由する信号が出力核に到達する.
直接路は基底核出力を減少させる(脱抑制)ため標的ニューロンが活動する(b).
最後に間接路の信号が出力核に到達して,標的ニューロンの活動は再び抑制される(c).
運動系ループでは,
出力核ニューロンに対するハイパー直接路〜直接路〜間接路による一連の時間的・空間的な調節作用は,
大脳皮質における不必要な運動プログラムの発現を抑制すると共に,
必要な運動プログラムを正確なタイミングで遂行するために有用であると考えられる[26].
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
24.Hikosaka O & Wurz RH : Modification of saccadic eye movements by GABA-related substances. II. Effects of muscimol in monkey substantia nigra pars reticulata. J Neurophysiol 53 : 292— 308, 1985.
25.Meyer-Luehmann M, Thompson JF, Berridge KC & Aldridge JW : Substantia nigra pars reticulata neurons code initiation of serial pattern : implications for natural action sequences and sequential disorders. Eur J Neurosci 16 : 1599— 1608, 2002.
26.Nambu A, Tokuno H, Hamada I, Kita H, Imanishi M, Akazawa T, Ikeuchi Y & Hasegawa N : Excitatory
cortical inputs to pallidal neurons via the subthalamic nucleus in the monkey. J Neurophysiol 84 : 289—300, 2000.
3—4;大脳基底核内の神経回路



大脳皮質から受け取った情報は,
基底核内の神経回路によりどの様に修飾されて出力されるのだろうか?
基底核の中で
視床下核ニューロンがグルタミン酸作動性,
黒質緻密部ニューロンがドーパミン作動性である以外は
全てGABA作動性(抑制性)である.
出力核である淡蒼球内節や黒質網様部のGABA作動性ニューロンは数10〜200Hzで発射しており[24, 25],
その発射頻度は次の3経路により調節されている.
?@ハイパー直接路(Hyper-direct pathway);
大脳皮質から興奮性入力を受ける視床下核ニューロンが,
出力核のGABA作動性ニューロンに単シナプス性に投射する経路.
この経路は最も短時間で出力ニューロンに到達し,その発射頻度を増加させるため
基底核の抑制性出力は亢進する.
?A直接路(Direct pathway);
GABAとサブスタンスPを持つ線条体ニューロンが出力核に単シナプス性に投射する経路.
ドーパミンはD1受容体を介してこの線条体ニューロン群を興奮させるため直接路の活動は亢進する.
その結果,基底核の抑制性出力は減少する.
?B間接路(Indirect pathway);
GABAとエンケファリンを持つ線条体ニューロンが
多シナプス性に淡蒼球外節のGABA作動性ニューロンと
視床下核のグルタミン酸作動性ニューロンを介して出力核に投射する経路.
この経路が働くと基底核の出力は増加する.
ドーパミンはD2受容体を介してこれらの細胞を抑制するので間接路の活動は低下し,
基底核の出力は減少する.
それでは,これらの3経路はどの様な仕組みで基底核からの出力をコントロールするのであろうか.
大脳皮質からの信号はまずハイパー直接路を興奮させ,
視床—大脳皮質投射ニューロンや脳幹ニューロンを広く抑制する(a).
次に直接路を経由する信号が出力核に到達する.
直接路は基底核出力を減少させる(脱抑制)ため標的ニューロンが活動する(b).
最後に間接路の信号が出力核に到達して,標的ニューロンの活動は再び抑制される(c).
運動系ループでは,
出力核ニューロンに対するハイパー直接路〜直接路〜間接路による一連の時間的・空間的な調節作用は,
大脳皮質における不必要な運動プログラムの発現を抑制すると共に,
必要な運動プログラムを正確なタイミングで遂行するために有用であると考えられる[26].
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
24.Hikosaka O & Wurz RH : Modification of saccadic eye movements by GABA-related substances. II. Effects of muscimol in monkey substantia nigra pars reticulata. J Neurophysiol 53 : 292— 308, 1985.
25.Meyer-Luehmann M, Thompson JF, Berridge KC & Aldridge JW : Substantia nigra pars reticulata neurons code initiation of serial pattern : implications for natural action sequences and sequential disorders. Eur J Neurosci 16 : 1599— 1608, 2002.
26.Nambu A, Tokuno H, Hamada I, Kita H, Imanishi M, Akazawa T, Ikeuchi Y & Hasegawa N : Excitatory
cortical inputs to pallidal neurons via the subthalamic nucleus in the monkey. J Neurophysiol 84 : 289—300, 2000.
2019年05月16日
3.基底核の入出力と神経回路の機能?A
最終的には、心の働きの脳内メカニス?ムについて述べていきます。
3.基底核の入出力と神経回路の機能?A
3—3;基底核—脳幹系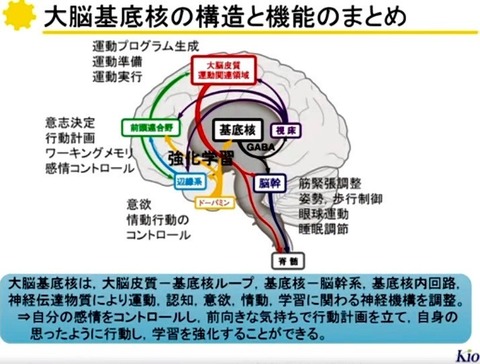
基底核から脳幹への投射は,
脳幹内の運動パターン形成機構を介して発現する(生得的な)運動の調節に関与する.
上丘への投射は眼球運動に,
脚橋被蓋核領域への投射は筋緊張や歩行運動に,
延髄網様体への投射は咀嚼運動や嚥下運動などの口腔顔面運動を調節する[17].
(1)筋緊張の調節
中脳被蓋に存在する脚橋被蓋核(Pedunculopontine tegmental nucleus;PPN)は筋緊張の制御に関与する[18].
筋緊張の抑制系は脚橋被蓋核のコリン作動性ニューロンに始まり,橋・延髄網様体脊髄路を下行する.
さらに脊髄の抑制性介在細胞(Ib介在細胞を含む)を経由してα運動細胞・γ運動細胞・介在細胞群を抑制する[19].
一方,モノアミン作動性下行路(青斑核脊髄路・縫線核脊髄路)は筋緊張の促通系として働く.
抑制系は促通系の活動を抑制する[20].
脚橋被蓋核は淡蒼球内節や黒質網様部から豊富な線維投射を受けており[21],
基底核は抑制系の活動を調節すると共に,
二次的に促通系の活動を変化させることで筋緊張を制御すると考えられる.
(2)歩行運動の調節
ネコやラット,サルの脚橋被蓋核の近傍には歩行誘発野が存在し,
歩行運動の開始や遂行に関与する[22].
Masdeuら[23]は,中脳被蓋の微小脳梗塞により歩行と起立のみが不能になった臨床例を報告し,
ヒトにおいても歩行誘発野が存在することを示した.
黒質網様部から歩行誘発領域へのGABA作動性投射は,
歩行運動の開始や停止・歩行リズム・歩行速度などを調節する[18].
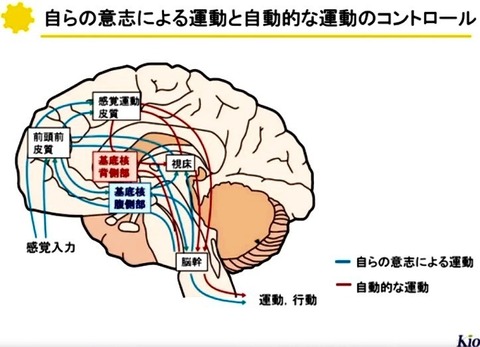
(3)大脳皮質と基底核による二重支配
上丘や中脳被蓋(筋緊張抑制野や歩行誘発野などを含む)には基底核からの抑制入力に加えて,
大脳皮質からの興奮性入力も収束する.
従って脳幹の運動システムは
大脳皮質—基底核ループを経由する随意的制御と
基底核—脳幹系による自動的制御の双方を受けると考えることができる.
行動の発現に際して,
大脳皮質—基底核ループで構成される行動プランや
運動プログラムが適切な運動に変換される過程には
基底核—脳幹系による無意識の調節が働くと推測される.
そして基底核疾患における多くの運動障害の背景には,
この二つのシステムの機能異常が存在する.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
17.彦坂興秀:随意運動における大脳基底核の役割 In:脳とニューラルネット,Eds. 甘利俊一 & 酒田英
夫,朝倉書店,pp 218— 234, 1994.
18.Takakusaki K, Habaguchi T, Ohtinata-Sugimoto J, Saitoh K & Sakamoto T : Basal ganglia efferents to
the brainstem centers controlling postural muscle tone and locomotion ; A new concept for understanding motor disorders in basal ganglia dysfunction. Neurosci : in press.
19.Takakusaki K, Kohyama J, Matsuyama K & Mori S : Medullary reticulospinal tract mediation of generalized motor inhibition in cats : Parallel inhibitory mechanisms acting on motoneurons and on interneuronal transmission in reflex pathways. Neurosci 103, 511— 527, 2001.
20.Mileykovskiy BY, Kiyashchenko LI, Kodama T, Lai YY & Siegel JM : Activation of pontine and medullary motor inhibitory regions reduces discharge in neurons located in the locus coeruleus and the anatomical equivalent of the midbrain locomotor region. J Neurosci 20 : 8551— 8558, 2000.
21.Inglis WL & Winn P : The pedunculopontine tegmental nucleus : where the striatum meets the reticular
formation. Prog Neurobiol 47 : 1— 29, 1995.
22.Grillner S: Control of locomotion in bipeds, tetrapods, and fish. In : The Nervous System II, Ed. Brooks VB,
Am. Physiol. Soc. Press, Bethesda, pp 1179 — 1236, 1981.
23.Masdeu JC, Alampur U, Cavaliere R & Tavoulareas G : Astasia and gait failure with damage of the pontomesencephalic locomotor region. Ann Neurol 35 : 619— 621, 1994.
3.基底核の入出力と神経回路の機能?A
3—3;基底核—脳幹系

基底核から脳幹への投射は,
脳幹内の運動パターン形成機構を介して発現する(生得的な)運動の調節に関与する.
上丘への投射は眼球運動に,
脚橋被蓋核領域への投射は筋緊張や歩行運動に,
延髄網様体への投射は咀嚼運動や嚥下運動などの口腔顔面運動を調節する[17].

(1)筋緊張の調節
中脳被蓋に存在する脚橋被蓋核(Pedunculopontine tegmental nucleus;PPN)は筋緊張の制御に関与する[18].
筋緊張の抑制系は脚橋被蓋核のコリン作動性ニューロンに始まり,橋・延髄網様体脊髄路を下行する.
さらに脊髄の抑制性介在細胞(Ib介在細胞を含む)を経由してα運動細胞・γ運動細胞・介在細胞群を抑制する[19].
一方,モノアミン作動性下行路(青斑核脊髄路・縫線核脊髄路)は筋緊張の促通系として働く.
抑制系は促通系の活動を抑制する[20].
脚橋被蓋核は淡蒼球内節や黒質網様部から豊富な線維投射を受けており[21],
基底核は抑制系の活動を調節すると共に,
二次的に促通系の活動を変化させることで筋緊張を制御すると考えられる.
(2)歩行運動の調節
ネコやラット,サルの脚橋被蓋核の近傍には歩行誘発野が存在し,
歩行運動の開始や遂行に関与する[22].
Masdeuら[23]は,中脳被蓋の微小脳梗塞により歩行と起立のみが不能になった臨床例を報告し,
ヒトにおいても歩行誘発野が存在することを示した.
黒質網様部から歩行誘発領域へのGABA作動性投射は,
歩行運動の開始や停止・歩行リズム・歩行速度などを調節する[18].
(3)大脳皮質と基底核による二重支配
上丘や中脳被蓋(筋緊張抑制野や歩行誘発野などを含む)には基底核からの抑制入力に加えて,
大脳皮質からの興奮性入力も収束する.
従って脳幹の運動システムは
大脳皮質—基底核ループを経由する随意的制御と
基底核—脳幹系による自動的制御の双方を受けると考えることができる.
行動の発現に際して,
大脳皮質—基底核ループで構成される行動プランや
運動プログラムが適切な運動に変換される過程には
基底核—脳幹系による無意識の調節が働くと推測される.
そして基底核疾患における多くの運動障害の背景には,
この二つのシステムの機能異常が存在する.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
17.彦坂興秀:随意運動における大脳基底核の役割 In:脳とニューラルネット,Eds. 甘利俊一 & 酒田英
夫,朝倉書店,pp 218— 234, 1994.
18.Takakusaki K, Habaguchi T, Ohtinata-Sugimoto J, Saitoh K & Sakamoto T : Basal ganglia efferents to
the brainstem centers controlling postural muscle tone and locomotion ; A new concept for understanding motor disorders in basal ganglia dysfunction. Neurosci : in press.
19.Takakusaki K, Kohyama J, Matsuyama K & Mori S : Medullary reticulospinal tract mediation of generalized motor inhibition in cats : Parallel inhibitory mechanisms acting on motoneurons and on interneuronal transmission in reflex pathways. Neurosci 103, 511— 527, 2001.
20.Mileykovskiy BY, Kiyashchenko LI, Kodama T, Lai YY & Siegel JM : Activation of pontine and medullary motor inhibitory regions reduces discharge in neurons located in the locus coeruleus and the anatomical equivalent of the midbrain locomotor region. J Neurosci 20 : 8551— 8558, 2000.
21.Inglis WL & Winn P : The pedunculopontine tegmental nucleus : where the striatum meets the reticular
formation. Prog Neurobiol 47 : 1— 29, 1995.
22.Grillner S: Control of locomotion in bipeds, tetrapods, and fish. In : The Nervous System II, Ed. Brooks VB,
Am. Physiol. Soc. Press, Bethesda, pp 1179 — 1236, 1981.
23.Masdeu JC, Alampur U, Cavaliere R & Tavoulareas G : Astasia and gait failure with damage of the pontomesencephalic locomotor region. Ann Neurol 35 : 619— 621, 1994.
追加プレゼント申請
2019年05月15日
3.基底核の入出力と神経回路の機能?@
最終的には、心の働きの脳内メカニス?ムについて述べていきます。
3.基底核の入出力と神経回路の機能?@
基底核の機能を理解する上で重要なポイントは,
?@基底核への入出力系とその作用,
?A基底核内神経回路の仕組み,
?Bドーパミン作動系の働き,
の3点である.
3—1;基底核の入出力系の概略(図)
大脳皮質領域から線条体への入力系を皮質線条体投射(Corticostriatal projections)と呼ぶ.
異なった皮質領域に由来する情報は,
それぞれ基底核の異なった部位で処理された後に,
出力核から視床を介してもとの大脳皮質領域に戻る(視床─大脳皮質投射;Thalamocortical projection).
これらを併せて大脳皮質—基底核ループ(Corticobasal ganglia loop)と呼ぶ.
また基底核の出力は脳幹の活動を調節する(基底核—脳幹系;Basalganglia-brainstem system).
即ち,基底核は2つのルートを用いて運動を制御する.
大脳皮質—基底核ループで修飾された情報は,
皮質核路や皮質脊髄路を,
そして,基底核—脳幹系は脳幹からの下行路を
それぞれ経由して行動を制御する[3].
歩行運動を例にとれば,
前者は歩行の開始や停止・障害物を避ける随意的運動過程に,
後者は歩行時のリズミカルな手足の動作や筋緊張の調節など
随意運動に随伴する自動的(無意識な)運動過程に関与する[14].
3—2;大脳皮質—基底核ループ
大脳皮質—基底核ループには次の4種類が存在する.
サルを用いた研究により各々のループの構造や機能が明らかになってきた.
ここでは,各ループの概略を示すに留めるが,
詳細についてはAlexander et al.[15]やMiddleton and Strick[4]などの総説を参照して頂きたい.
(1)運動系ループ(Motor loop);
大脳皮質運動関連領域(一次運動野,補足運動野,運動前野,前補足運動野,帯状皮質運動野)と主に被殻とを結ぶループは運動機能に関与する.
各々の領域は運動の遂行に際して異なる機能を担う.
このループにおける基底核出力は,主に淡蒼球内節から視床腹側核群(外側腹側核や前腹側核)を経由して
補足運動野・運動前野・一次運動野へと戻る.
運動系ループにはサブループが存在する.
一次運動野から始まるサブループは運動遂行(運動量や運
動速度)に,運動前野・補足運動野と基底核とを結ぶサブループは
運動プログラムや運動準備などに関与すると考えられている.
また,運動系ループには体部位局在が存在し,
体の各々の部位の運動は体部位局在に基づく個々のループで調節される[16].
(2)前頭前野系ループ(Prefrontal loop);
前頭連合野と尾状核・被殻吻側部を結ぶ前頭前野系ループは認知情報や記憶(特にワーキングメモリー;Working memory)を有効に活用し,意志の発動や行動計画,注意,社会行動などの高次脳機能の発現に関与する.
淡蒼球内節と黒質網様部からの出力は,視床背内側核や前腹側核を経由して前頭連合野や運動前野に戻る.
(3)辺縁系ループ(Limbic loop);
辺縁皮質は側座核を中心とする尾状核の腹側部に投射し,
黒質網様部からの入力を受ける.
側座核は辺縁系(扁桃体,海馬,視床下部,側頭葉など)からの興奮性入力や
腹側被蓋野からのドーパミン作動性入力も受けている.
辺縁皮質と前頭前野には強い線維連絡があり,
このループは前頭前野系ループと共に,
認知情報の評価,情動や感情の表出,意欲などの高次脳機能や精神活動に関与する.
(4)眼球運動ループ(Oculomotor loop);
眼球運動領域(前頭眼野・補足眼野)と尾状核とを結ぶループは眼球運動に関与する.
このループで処理された情報は,眼球運動領域から上丘や橋の注視中枢へ送られると共に,
黒質網様部から上丘への線維投射を介して眼球運動を制御する.
特に後者はサッケード(Saccade;視野の中の物体に視線を向ける速い眼球運動)の発現に関与する.
基底核による運動調節メカニズムは,尾状核〜黒質網様部〜上丘系において最も解析が進んでおり[3],
この系におけるニューロン活動の動作原理が,大脳皮質─基底核ループや基底核─脳幹系の機能を解明する上での基盤となっている.
各々のループは独立して並列的な情報処理をすると考えられている.
しかし,ループ間での相互作用が基底核内において存在するのか否かは必ずしも明確になっていない.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
3.Hikosaka O, Takikawa Y, Kawagoe R : Role of the basal ganglia in the control of purposive saccadic eye
movements. Physiol Rev 80 : 953— 978, 2000.
4.Middleton FA & Strick PL : Basal ganglia and cerebellar loops : motor and cognitive circuits. Brain Res
Rev 31 : 236— 350, 2000.
14.高草木薫,斉藤和也,幅口竜也 & 杉本純子:大脳基底核による歩行と筋緊張の制御.脳の科学 23 ; 1049
— 1054, 2001.
15.Alexander GE, Delong MR & Strick PE : Parallel organization of functionally segregated circuits linking
basal ganglia and cortex. Ann Rev Neurosci 9 : 357—381, 1986.
16.Delong MR : The basal ganglia. In : Principles of neural science, 4th edition, Ed. Kandel ER, Schwartz JH
& Jessell TM, McGraw-Hill Press, Heath Professions Division pp 853-867, 2000
3.基底核の入出力と神経回路の機能?@

基底核の機能を理解する上で重要なポイントは,
?@基底核への入出力系とその作用,
?A基底核内神経回路の仕組み,
?Bドーパミン作動系の働き,
の3点である.
3—1;基底核の入出力系の概略(図)
大脳皮質領域から線条体への入力系を皮質線条体投射(Corticostriatal projections)と呼ぶ.
異なった皮質領域に由来する情報は,
それぞれ基底核の異なった部位で処理された後に,
出力核から視床を介してもとの大脳皮質領域に戻る(視床─大脳皮質投射;Thalamocortical projection).
これらを併せて大脳皮質—基底核ループ(Corticobasal ganglia loop)と呼ぶ.
また基底核の出力は脳幹の活動を調節する(基底核—脳幹系;Basalganglia-brainstem system).
即ち,基底核は2つのルートを用いて運動を制御する.
大脳皮質—基底核ループで修飾された情報は,
皮質核路や皮質脊髄路を,
そして,基底核—脳幹系は脳幹からの下行路を
それぞれ経由して行動を制御する[3].
歩行運動を例にとれば,
前者は歩行の開始や停止・障害物を避ける随意的運動過程に,
後者は歩行時のリズミカルな手足の動作や筋緊張の調節など
随意運動に随伴する自動的(無意識な)運動過程に関与する[14].
3—2;大脳皮質—基底核ループ
大脳皮質—基底核ループには次の4種類が存在する.
サルを用いた研究により各々のループの構造や機能が明らかになってきた.
ここでは,各ループの概略を示すに留めるが,
詳細についてはAlexander et al.[15]やMiddleton and Strick[4]などの総説を参照して頂きたい.
(1)運動系ループ(Motor loop);
大脳皮質運動関連領域(一次運動野,補足運動野,運動前野,前補足運動野,帯状皮質運動野)と主に被殻とを結ぶループは運動機能に関与する.
各々の領域は運動の遂行に際して異なる機能を担う.
このループにおける基底核出力は,主に淡蒼球内節から視床腹側核群(外側腹側核や前腹側核)を経由して
補足運動野・運動前野・一次運動野へと戻る.
運動系ループにはサブループが存在する.
一次運動野から始まるサブループは運動遂行(運動量や運
動速度)に,運動前野・補足運動野と基底核とを結ぶサブループは
運動プログラムや運動準備などに関与すると考えられている.
また,運動系ループには体部位局在が存在し,
体の各々の部位の運動は体部位局在に基づく個々のループで調節される[16].
(2)前頭前野系ループ(Prefrontal loop);
前頭連合野と尾状核・被殻吻側部を結ぶ前頭前野系ループは認知情報や記憶(特にワーキングメモリー;Working memory)を有効に活用し,意志の発動や行動計画,注意,社会行動などの高次脳機能の発現に関与する.
淡蒼球内節と黒質網様部からの出力は,視床背内側核や前腹側核を経由して前頭連合野や運動前野に戻る.
(3)辺縁系ループ(Limbic loop);
辺縁皮質は側座核を中心とする尾状核の腹側部に投射し,
黒質網様部からの入力を受ける.
側座核は辺縁系(扁桃体,海馬,視床下部,側頭葉など)からの興奮性入力や
腹側被蓋野からのドーパミン作動性入力も受けている.
辺縁皮質と前頭前野には強い線維連絡があり,
このループは前頭前野系ループと共に,
認知情報の評価,情動や感情の表出,意欲などの高次脳機能や精神活動に関与する.
(4)眼球運動ループ(Oculomotor loop);
眼球運動領域(前頭眼野・補足眼野)と尾状核とを結ぶループは眼球運動に関与する.
このループで処理された情報は,眼球運動領域から上丘や橋の注視中枢へ送られると共に,
黒質網様部から上丘への線維投射を介して眼球運動を制御する.
特に後者はサッケード(Saccade;視野の中の物体に視線を向ける速い眼球運動)の発現に関与する.
基底核による運動調節メカニズムは,尾状核〜黒質網様部〜上丘系において最も解析が進んでおり[3],
この系におけるニューロン活動の動作原理が,大脳皮質─基底核ループや基底核─脳幹系の機能を解明する上での基盤となっている.
各々のループは独立して並列的な情報処理をすると考えられている.
しかし,ループ間での相互作用が基底核内において存在するのか否かは必ずしも明確になっていない.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
3.Hikosaka O, Takikawa Y, Kawagoe R : Role of the basal ganglia in the control of purposive saccadic eye
movements. Physiol Rev 80 : 953— 978, 2000.
4.Middleton FA & Strick PL : Basal ganglia and cerebellar loops : motor and cognitive circuits. Brain Res
Rev 31 : 236— 350, 2000.
14.高草木薫,斉藤和也,幅口竜也 & 杉本純子:大脳基底核による歩行と筋緊張の制御.脳の科学 23 ; 1049
— 1054, 2001.
15.Alexander GE, Delong MR & Strick PE : Parallel organization of functionally segregated circuits linking
basal ganglia and cortex. Ann Rev Neurosci 9 : 357—381, 1986.
16.Delong MR : The basal ganglia. In : Principles of neural science, 4th edition, Ed. Kandel ER, Schwartz JH
& Jessell TM, McGraw-Hill Press, Heath Professions Division pp 853-867, 2000
2019年05月14日
基底核の機能構造
最終的には、心の働きの脳内メカニス?ムについて述べていきます。
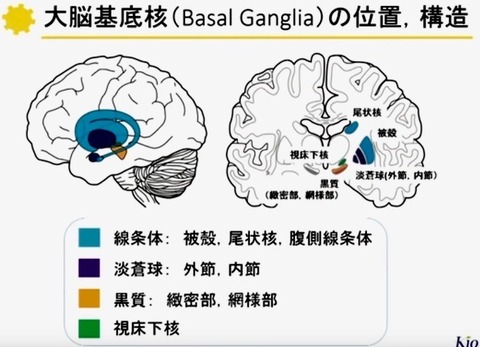
基底核の機能構造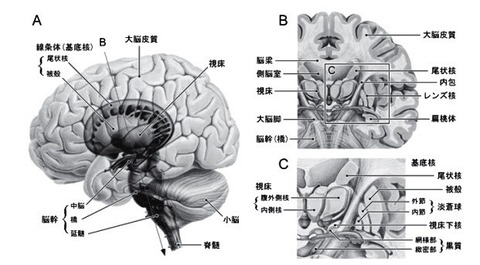
2—1;基底核の構築(図 2)
基底核は大脳半球の深部に存在する.
基底核は内包により尾状核とレンズ核(被殻・淡蒼球)に分けられ,内側には視床が存在する.
尾状核の尾部は辺縁系の一部である扁桃体へと連続する.
基底核は,
(新)線条体(Neostriatum),
淡蒼球(Globus pallidus),
黒質(Substantia nigra),
視床下核(Subthalamic nucleus)の4領域に分られる.
線条体は尾状核(Caudate nucleus)と被殻(Putamen)とからなり,
淡蒼球は,内節(Internal segment;GPi)と外節(Externalsegment;GPe)とからなる.
黒質(Substantianigra)は,緻密部(pars compacta;SNc)と網様部(pars reticulata;SNr)とに分けられる.
線条体は大脳皮質の広範な領域から入力を受ける.
淡蒼球内節と黒質網様部は基底核の出力核である.
その出力はγ-アミノ酪酸(gammaaminobutylic acid;GABA)を
神経伝達物質とする抑制性投射である.
視床下核,淡蒼球外節,黒質緻密部は基底核内の各々の神経核と線維連絡を持ち,
基底核内の神経回路活動を修飾する.
黒質緻密部は,
腹側被蓋野(Ventral tegmental nucleus;VTA)や
後赤核領域(Retrorubral field)と共に
神経伝達物質としてドーパミンを有している.
2—2;線条体の微細構造と神経細胞群
線条体は均一の構造に見えるが,マトリックス(Matrix)とパッチ(Patch)という2つのコンパートメントに分けられ,各々の領域は次の様な入出力系の特徴を持っている.
?@マトリックスは主に大脳皮質のIII層とVa層から,パッチはVb層と VI 層からの投射を受ける.
?A新皮質はパッチよりもマトリックスに多く投射し,その他の皮質はパッチに多く投射する.
?Bマトリックスに分布する投射ニューロンは淡蒼球や黒質網様部に投射し,
パッチに分布する投射ニューロンは主に黒質緻密部に投射する[5— 8].
線条体の80〜95%の細胞は線条体外へ線維を送る投射ニューロンであり,
GABAを伝達物質とする中型の有棘細胞(Medium spiny neurons)である.
5〜20%の細胞は線条体内の介在細胞である.
マウスやラットに比べて霊長類(サル)では投射細胞の比率は低い[9].
投射細胞は次の2群に大別される.
一群はGABAとエンケファリン(Enkephalin)やニューロテンシン(Neurotensin)を含有し,
ドーパミンD2受容体を持つ.
これらのニューロンは淡蒼球外節に投射して間接路を構成する.
もう一群の細胞はGABAとサブスタンスP(Substance P)やダイノルフィン(Dynorphine)を含有し,
ドーパミンD1受容体を有する.
そして淡蒼球内節や黒質網様部に投射して直接路を構成する[10, 11].
介在細胞には,
?@大型のコリン作動性ニューロン,
?A中型でソマトスタチン(Somatostatin),ニューロペプチドY(Neuropeptide Y),一酸化窒素(Nitric oxide)を持つニューロン,
?B中型で GABAを伝達物質とし,カルシウム結合蛋白質であるパルブアルブミン(Parvalbumin)を含
有するニューロンなどが存在する[10].
中でもコリン作動性ニューロンについての解析が進んでいる.
中脳からのドーパミン作動性投射とコリン作動性ニューロンとの相互作用が投射ニューロンの活動を調節する上で重要であり,基底核疾患ではこの相互作用がしばしば破綻する[11— 13].
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
5.Gerfen CR : The neostriatal mosaic : striatal patchmatrix organization is related to cortical lamination.
Science 246 : 385— 388, 1989.
6.Gerfen CR : The naostriatal mosaic : multiple levels of
compartmental organization in the basal ganglia.
Annu Rev Neurosci 15 : 285— 320, 1992.
7.Graybiel AM : Neurotransmitters and neuromodulators in the basal ganglia. Trends Neurosci 13 : 244—
254, 1990.
8.Kincaid AE & Wilson CJ : Corticostriatal innervation
of the patch and matrix in the rat neostriatum. J
Comp Neurol 374 : 578— 592, 1996.
9.Graveland GA & Difiglia M : The frequency and distribution of medium-sized neurons with indented nuclei in the primate and rodent neostriatum. Brain Res
327, 307— 311, 1985.
10.Kawaguchi Y : Neostriatal cell subtypes and their
functional roles. Neurosci Res 27 : 1— 8, 1997.
11.Mitchell IJ, Cooper AJ & Griffiths MR : The selective
vulnerability of striatopallidal neurons. Prog Neurobiol 59 : 691— 719, 1999.
12.Cicchetti F, Prensa L, Wu Y & Parent A : 2000.
Chemical anatomy of striatum interneurons in normal and individuals and in patients with Huntington’s
disease. Brain Res Rev 34 : 80— 101.
13.Zou F-M, Wilson CJ & Dani JA : Cholinergic interneuron characteristics and nicotinic properties in
the striatum. J Neurobiol 53 : 590— 605, 2002.
基底核の機能構造

2—1;基底核の構築(図 2)
基底核は大脳半球の深部に存在する.
基底核は内包により尾状核とレンズ核(被殻・淡蒼球)に分けられ,内側には視床が存在する.
尾状核の尾部は辺縁系の一部である扁桃体へと連続する.
基底核は,
(新)線条体(Neostriatum),
淡蒼球(Globus pallidus),
黒質(Substantia nigra),
視床下核(Subthalamic nucleus)の4領域に分られる.
線条体は尾状核(Caudate nucleus)と被殻(Putamen)とからなり,
淡蒼球は,内節(Internal segment;GPi)と外節(Externalsegment;GPe)とからなる.
黒質(Substantianigra)は,緻密部(pars compacta;SNc)と網様部(pars reticulata;SNr)とに分けられる.
線条体は大脳皮質の広範な領域から入力を受ける.
淡蒼球内節と黒質網様部は基底核の出力核である.
その出力はγ-アミノ酪酸(gammaaminobutylic acid;GABA)を
神経伝達物質とする抑制性投射である.
視床下核,淡蒼球外節,黒質緻密部は基底核内の各々の神経核と線維連絡を持ち,
基底核内の神経回路活動を修飾する.
黒質緻密部は,
腹側被蓋野(Ventral tegmental nucleus;VTA)や
後赤核領域(Retrorubral field)と共に
神経伝達物質としてドーパミンを有している.
2—2;線条体の微細構造と神経細胞群
線条体は均一の構造に見えるが,マトリックス(Matrix)とパッチ(Patch)という2つのコンパートメントに分けられ,各々の領域は次の様な入出力系の特徴を持っている.
?@マトリックスは主に大脳皮質のIII層とVa層から,パッチはVb層と VI 層からの投射を受ける.
?A新皮質はパッチよりもマトリックスに多く投射し,その他の皮質はパッチに多く投射する.
?Bマトリックスに分布する投射ニューロンは淡蒼球や黒質網様部に投射し,
パッチに分布する投射ニューロンは主に黒質緻密部に投射する[5— 8].
線条体の80〜95%の細胞は線条体外へ線維を送る投射ニューロンであり,
GABAを伝達物質とする中型の有棘細胞(Medium spiny neurons)である.
5〜20%の細胞は線条体内の介在細胞である.
マウスやラットに比べて霊長類(サル)では投射細胞の比率は低い[9].
投射細胞は次の2群に大別される.
一群はGABAとエンケファリン(Enkephalin)やニューロテンシン(Neurotensin)を含有し,
ドーパミンD2受容体を持つ.
これらのニューロンは淡蒼球外節に投射して間接路を構成する.
もう一群の細胞はGABAとサブスタンスP(Substance P)やダイノルフィン(Dynorphine)を含有し,
ドーパミンD1受容体を有する.
そして淡蒼球内節や黒質網様部に投射して直接路を構成する[10, 11].
介在細胞には,
?@大型のコリン作動性ニューロン,
?A中型でソマトスタチン(Somatostatin),ニューロペプチドY(Neuropeptide Y),一酸化窒素(Nitric oxide)を持つニューロン,
?B中型で GABAを伝達物質とし,カルシウム結合蛋白質であるパルブアルブミン(Parvalbumin)を含
有するニューロンなどが存在する[10].
中でもコリン作動性ニューロンについての解析が進んでいる.
中脳からのドーパミン作動性投射とコリン作動性ニューロンとの相互作用が投射ニューロンの活動を調節する上で重要であり,基底核疾患ではこの相互作用がしばしば破綻する[11— 13].
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
5.Gerfen CR : The neostriatal mosaic : striatal patchmatrix organization is related to cortical lamination.
Science 246 : 385— 388, 1989.
6.Gerfen CR : The naostriatal mosaic : multiple levels of
compartmental organization in the basal ganglia.
Annu Rev Neurosci 15 : 285— 320, 1992.
7.Graybiel AM : Neurotransmitters and neuromodulators in the basal ganglia. Trends Neurosci 13 : 244—
254, 1990.
8.Kincaid AE & Wilson CJ : Corticostriatal innervation
of the patch and matrix in the rat neostriatum. J
Comp Neurol 374 : 578— 592, 1996.
9.Graveland GA & Difiglia M : The frequency and distribution of medium-sized neurons with indented nuclei in the primate and rodent neostriatum. Brain Res
327, 307— 311, 1985.
10.Kawaguchi Y : Neostriatal cell subtypes and their
functional roles. Neurosci Res 27 : 1— 8, 1997.
11.Mitchell IJ, Cooper AJ & Griffiths MR : The selective
vulnerability of striatopallidal neurons. Prog Neurobiol 59 : 691— 719, 1999.
12.Cicchetti F, Prensa L, Wu Y & Parent A : 2000.
Chemical anatomy of striatum interneurons in normal and individuals and in patients with Huntington’s
disease. Brain Res Rev 34 : 80— 101.
13.Zou F-M, Wilson CJ & Dani JA : Cholinergic interneuron characteristics and nicotinic properties in
the striatum. J Neurobiol 53 : 590— 605, 2002.
2019年05月13日
脳の進化と基底核
最終的には、心の働きの脳内メカニス?ムについて述べていきます。
脳の進化と基底核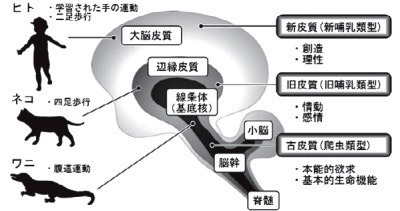
マクリーンは「有益な祖先の神経機構を継承し,生存競争に勝つべく新しい構造を積み上げることにより脳が進化した」と考え,脳の三層構造(三位一体説を提唱した[1](図1).
深層(古皮質)は生きている「生存」のための脳幹・脊髄,
中間層(旧皮質)は逞しく生きる「感情」を支える大脳辺縁系,
そして表層(新皮質)は旨く生きて行くための思考や創造など「理性」を支える大脳皮質である.
この三者の統合的な相互作用により高次脳機能が発揮される.
即ち,高次脳も生存や感情という古い脳を土台としている.
運動機能は,爬虫類における腹這運動(主に体幹運動)〜イヌ・ネコにおける四足歩行〜ヒトにおける二足歩行という過程で進化してきた.
この進化を支えているのが抗重力筋と姿勢制御機構の発達である.
この特徴はヒトにおける運動機能の生後発達においても認められる.
ヒトは生後1年数か月の間に二足歩行を獲得する.
そのプロセスは,頸部〜体幹〜下肢の伸展,体重の支持,そして姿勢制御に必要な神経機構の獲得でもある.
即ち二足歩行の獲得には,抗重力筋の発達と姿勢の制御が必須である.
パーキンソン病において歩行や姿勢反射,筋緊張の異常が出現することを考慮すると,基底核は抗重力筋活動や姿勢の制御に強く関わっていると考えられる.
爬虫類の古線条皮質(基底核の原型)と視葉(上丘に相当する)は眼球運動に関与する.
これらは視野に入る像がどこにあるのかを認知するシステムであり,
動くもの=餌という認知機能は爬虫類において既に存在しており,
古線条皮質の出力は脳幹を経由して眼球運動や捕食行動を発現させる[2, 3].
ヒトやサルなど高等な霊長類では大脳皮質が高度に発達し,
その過程で基底核は辺縁系や大脳皮質とも密な線維連絡を持つ様になった.
精神機能や高次脳機能の制御にはこれらの線維連絡が重要な役割を持つ[4].
即ち脳の進化に伴い,
基底核は脳幹に加えて辺縁系や大脳皮質の活動をも調節する様になり,
情動や繊細な運動機能,そして高次脳機能を制御する様になった.
このことは基底核疾患において運動障害のみならず,
精神障害や高次脳機能障害が誘発されることに反映される.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
1.MacLean PD, 1970. In the Neuroscience, Second
study program, Ed. Schmitt FO, Rockfeller Univ.
Press, New York, pp 336— 349, 1970.
2.Marin O, Smeets WJAJ & Gonzalez A : Evolution of
the basal ganglia in tetrapods : a new perspective
based on recent studies in amphibians. Trend Neurosci 21 : 487— 494, 1998.
3.Hikosaka O, Takikawa Y, Kawagoe R : Role of the
basal ganglia in the control of purposive saccadic eye
movements. Physiol Rev 80 : 953— 978, 2000.
4.Middleton FA & Strick PL : Basal ganglia and cerebellar loops : motor and cognitive circuits. Brain Res
Rev 31 : 236— 350, 2000.
脳の進化と基底核

マクリーンは「有益な祖先の神経機構を継承し,生存競争に勝つべく新しい構造を積み上げることにより脳が進化した」と考え,脳の三層構造(三位一体説を提唱した[1](図1).
深層(古皮質)は生きている「生存」のための脳幹・脊髄,
中間層(旧皮質)は逞しく生きる「感情」を支える大脳辺縁系,
そして表層(新皮質)は旨く生きて行くための思考や創造など「理性」を支える大脳皮質である.
この三者の統合的な相互作用により高次脳機能が発揮される.
即ち,高次脳も生存や感情という古い脳を土台としている.
運動機能は,爬虫類における腹這運動(主に体幹運動)〜イヌ・ネコにおける四足歩行〜ヒトにおける二足歩行という過程で進化してきた.
この進化を支えているのが抗重力筋と姿勢制御機構の発達である.
この特徴はヒトにおける運動機能の生後発達においても認められる.
ヒトは生後1年数か月の間に二足歩行を獲得する.
そのプロセスは,頸部〜体幹〜下肢の伸展,体重の支持,そして姿勢制御に必要な神経機構の獲得でもある.
即ち二足歩行の獲得には,抗重力筋の発達と姿勢の制御が必須である.
パーキンソン病において歩行や姿勢反射,筋緊張の異常が出現することを考慮すると,基底核は抗重力筋活動や姿勢の制御に強く関わっていると考えられる.
爬虫類の古線条皮質(基底核の原型)と視葉(上丘に相当する)は眼球運動に関与する.
これらは視野に入る像がどこにあるのかを認知するシステムであり,
動くもの=餌という認知機能は爬虫類において既に存在しており,
古線条皮質の出力は脳幹を経由して眼球運動や捕食行動を発現させる[2, 3].
ヒトやサルなど高等な霊長類では大脳皮質が高度に発達し,
その過程で基底核は辺縁系や大脳皮質とも密な線維連絡を持つ様になった.
精神機能や高次脳機能の制御にはこれらの線維連絡が重要な役割を持つ[4].
即ち脳の進化に伴い,
基底核は脳幹に加えて辺縁系や大脳皮質の活動をも調節する様になり,
情動や繊細な運動機能,そして高次脳機能を制御する様になった.
このことは基底核疾患において運動障害のみならず,
精神障害や高次脳機能障害が誘発されることに反映される.
【引用文献】
大脳基底核の機能;パーキンソン病との関連において
旭川医科大学 生理学第二講座
高草木 薫
参考文献
1.MacLean PD, 1970. In the Neuroscience, Second
study program, Ed. Schmitt FO, Rockfeller Univ.
Press, New York, pp 336— 349, 1970.
2.Marin O, Smeets WJAJ & Gonzalez A : Evolution of
the basal ganglia in tetrapods : a new perspective
based on recent studies in amphibians. Trend Neurosci 21 : 487— 494, 1998.
3.Hikosaka O, Takikawa Y, Kawagoe R : Role of the
basal ganglia in the control of purposive saccadic eye
movements. Physiol Rev 80 : 953— 978, 2000.
4.Middleton FA & Strick PL : Basal ganglia and cerebellar loops : motor and cognitive circuits. Brain Res
Rev 31 : 236— 350, 2000.
2019年05月12日
”怒り”の感情について
最終的には、心の働きの脳内メカニス?ムについて述べていきます。
”怒り”の感情について
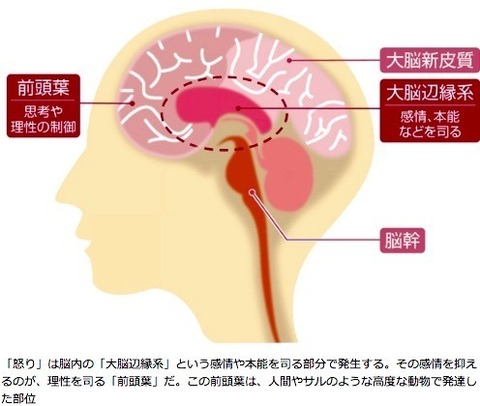
大脳は、大きく分けると
「大脳新皮質」
「大脳辺縁系」
「脳幹」
という3つの構造で構成されていて、それぞれに役割がある。
表面部分にある大脳新皮質では、思考や判断といった、
私たちがよりよく生きるための「知性」に関することを司る。
大脳の内側にある大脳辺縁系では、意欲や情緒といった、
私たちの本能に近い「感情」に関することを司る。
脳と脊髄を結ぶ脳幹では、「生命維持」に関することを司る。
怒りをはじめ、不安や恐怖といった、
いわゆる「情動」と呼ばれる感情が起きているときは、
大脳辺縁系が活発に動く。
大脳辺縁系は、
サルや犬、うさぎやトカゲのような動物も共通して持っている原始的な部位で、
人間を含めたそれぞれの動物の本能的な行動や感情に関わっている。
たとえば、「怖そうな敵が現れた。不安だから逃げよう」
「自分の縄張りを侵す者がいる。戦いを挑もう」といったときには、
大脳辺縁系が活性化していることになる。
一方、怒りなどのさまざまな感情をコントロールする機能や理性的な判断、
論理的な思考やコミュニケーションといったことを行うのが、
大脳新皮質のなかにある「前頭葉」と呼ばれる場所。
前頭葉は、人間やサルのような高度な動物で発達した部位だ。
たとえば、
「ホラー映画を観て恐怖を感じても、パニック状態にならずに済む」
「膨大な仕事量を前にして不安になっても、
『目の前のことからコツコツやっていけばいつかは終わる』と思い直せる」などと、
感情的な状態から冷静さを取り戻すことができるのは、
前頭葉がよく働くせいだと考えられている。
怒りの感情は、「大脳辺縁系で生じ、それを前頭葉で抑える」という構図となっている。
この2つの部位の働きによって、怒りの感情は引き起こされたり抑制されたりしている。
”怒り”の感情について

大脳は、大きく分けると
「大脳新皮質」
「大脳辺縁系」
「脳幹」
という3つの構造で構成されていて、それぞれに役割がある。
表面部分にある大脳新皮質では、思考や判断といった、
私たちがよりよく生きるための「知性」に関することを司る。
大脳の内側にある大脳辺縁系では、意欲や情緒といった、
私たちの本能に近い「感情」に関することを司る。
脳と脊髄を結ぶ脳幹では、「生命維持」に関することを司る。
怒りをはじめ、不安や恐怖といった、
いわゆる「情動」と呼ばれる感情が起きているときは、
大脳辺縁系が活発に動く。
大脳辺縁系は、
サルや犬、うさぎやトカゲのような動物も共通して持っている原始的な部位で、
人間を含めたそれぞれの動物の本能的な行動や感情に関わっている。
たとえば、「怖そうな敵が現れた。不安だから逃げよう」
「自分の縄張りを侵す者がいる。戦いを挑もう」といったときには、
大脳辺縁系が活性化していることになる。
一方、怒りなどのさまざまな感情をコントロールする機能や理性的な判断、
論理的な思考やコミュニケーションといったことを行うのが、
大脳新皮質のなかにある「前頭葉」と呼ばれる場所。
前頭葉は、人間やサルのような高度な動物で発達した部位だ。
たとえば、
「ホラー映画を観て恐怖を感じても、パニック状態にならずに済む」
「膨大な仕事量を前にして不安になっても、
『目の前のことからコツコツやっていけばいつかは終わる』と思い直せる」などと、
感情的な状態から冷静さを取り戻すことができるのは、
前頭葉がよく働くせいだと考えられている。
怒りの感情は、「大脳辺縁系で生じ、それを前頭葉で抑える」という構図となっている。
この2つの部位の働きによって、怒りの感情は引き起こされたり抑制されたりしている。








